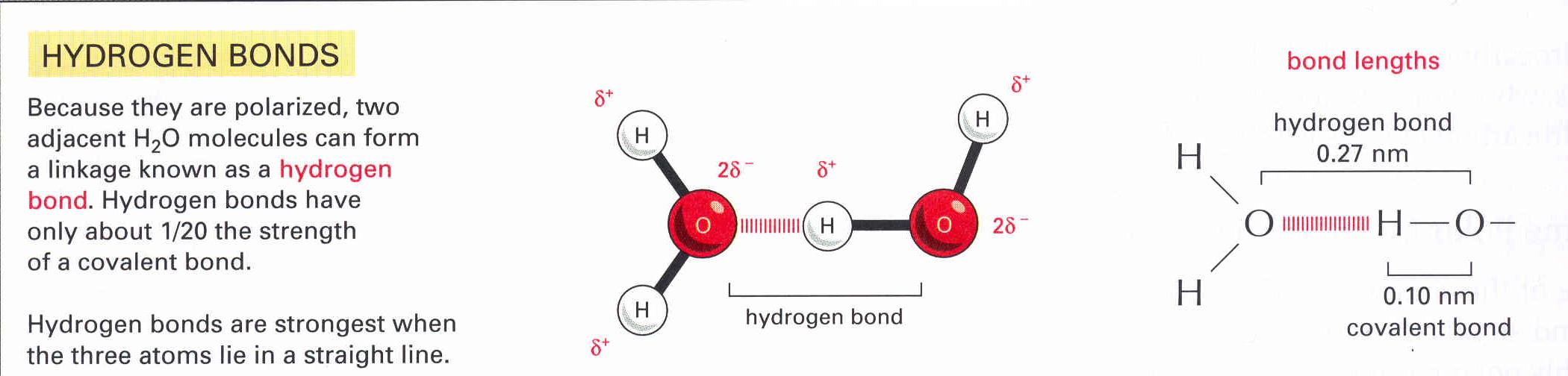
3.ábra Hidrogén-híd
kialakulása
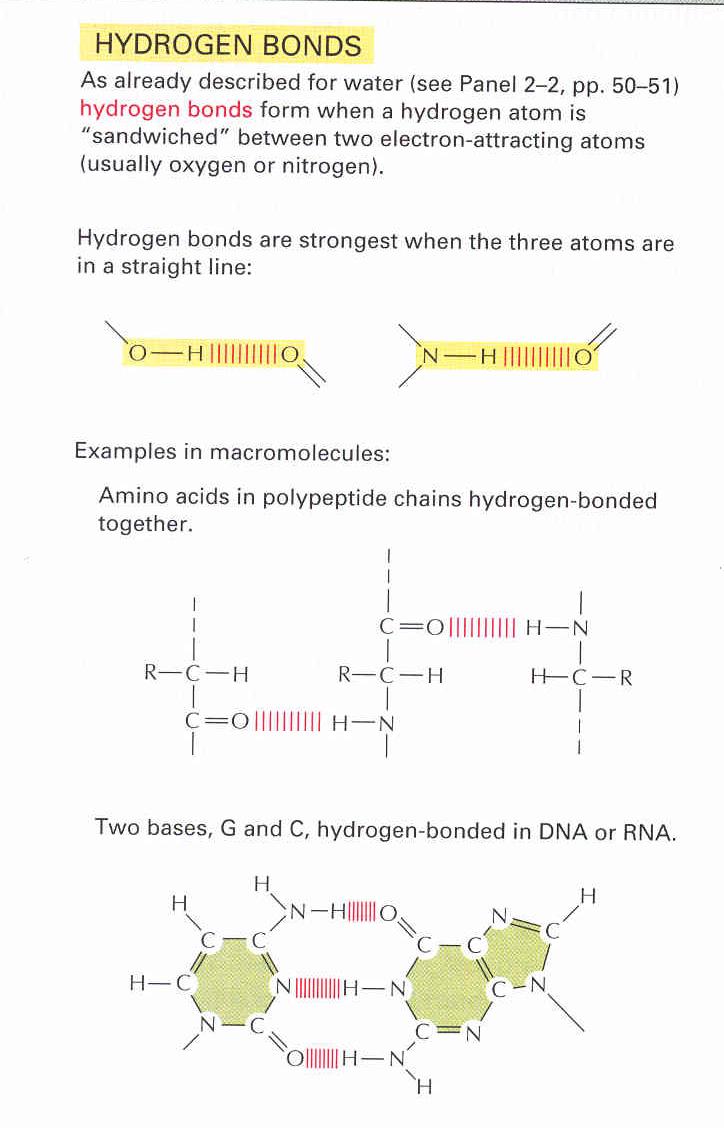
4.ábra Hidrogén-hídak kialakulása különböző funkciós csoportok között.
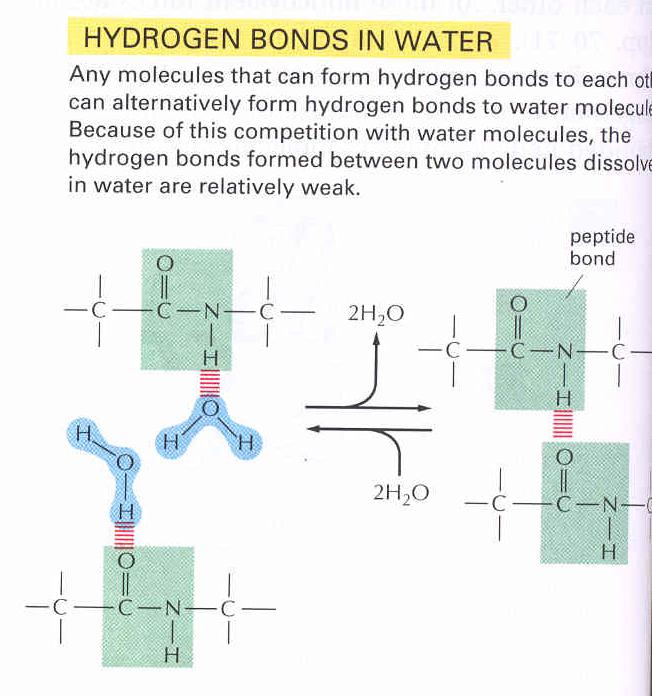
5. ábra Hidrogén-hidak kialakulása vizes oldatban
Vissza
az elejére
Szerves vegyületek, zsírok, zsírsavak,
gliceridek
A szerves vegyületeket felépítő legfontosabb
elemek a C, N, O, P. Ezen atomok kombinációjával számos élő szervezetet
felépítő fehérjék építhetők fel.
A zsírsavak (mint pl. palmitinsav vagy sztearinsav) 2 fő részre
bonthatók. Van egy hosszú szénláncú apoláris
csoportja (pl C16) mely hidrofób
tulajdonságú és kevésbé reakcióképes poláris csoportot tartalmazó ún.
karboxil-csoport. A -COOH csoport hidrogénje disszociábilis, ennélfogva
ezek a molekulák gyengén savas karakterűek. A zsirsavmolekulák karboxilcsoport felöli oldala hidrofil tulajdonságú illetve
kémiailag aktivabb (reakcióképesebb).
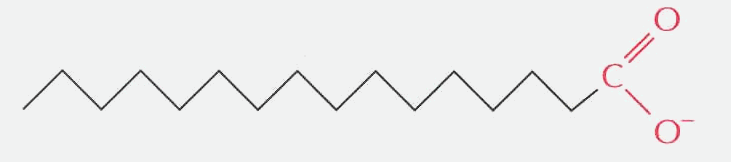
6. ábra Palmitinsav molekula
szerkezete
A sejtmembránok fontos komponense a
zsírsavak illetve annak származékai. Ha 3 zsírsavmolekulát
glicerinnel észteresítjük, akkor az ún. zsírokhoz (trigliceridek)
jutunk, melyek az élő szervezet szempontjából fontos energiaforrás. Ha
egy glicerinmolekulát 2 molekula zsírsavval és egy molekula foszfát
csoporttal észteresítünk, akkor pedig
foszfolipidhez jutunk.
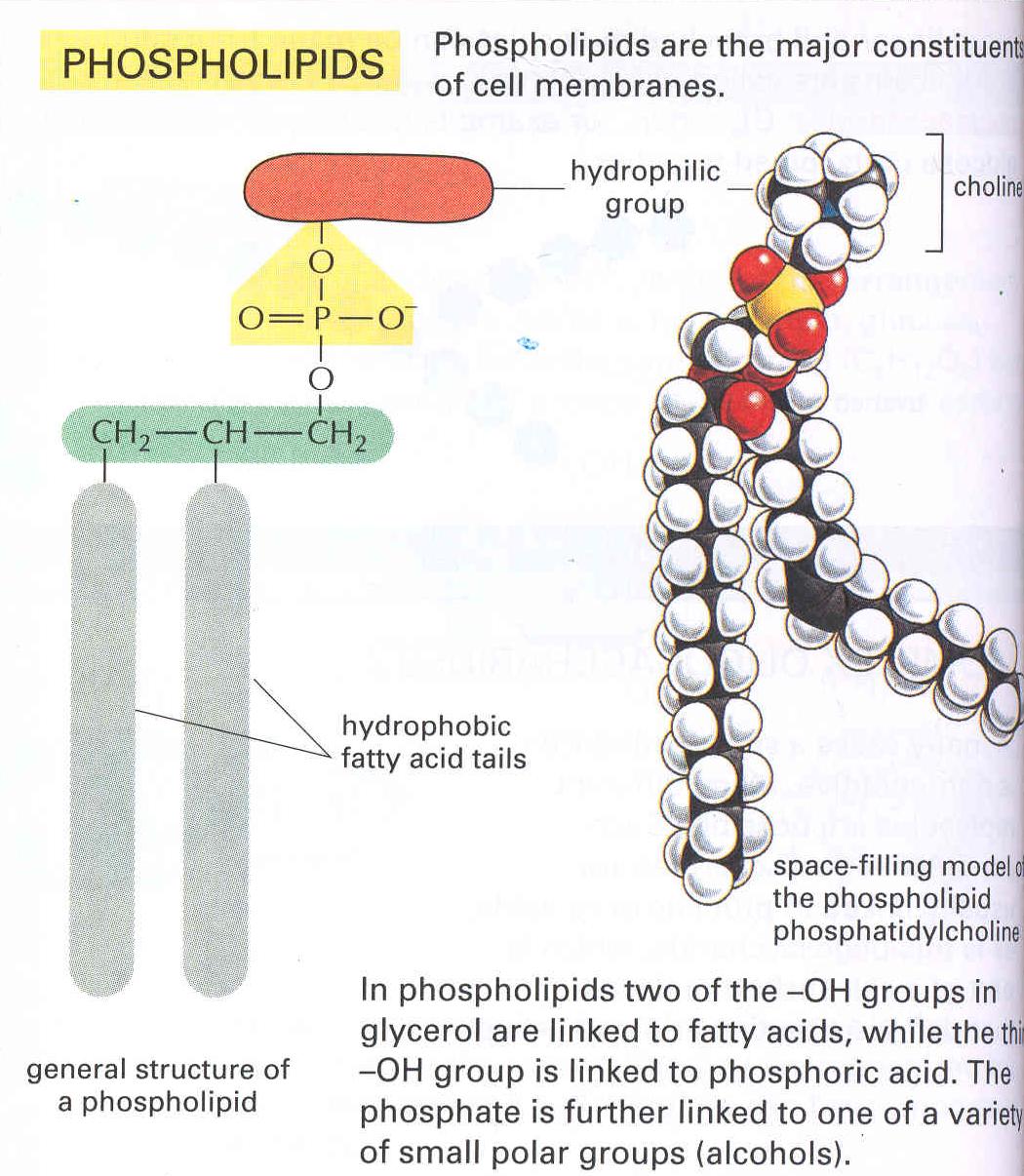
7. ábra foszfolipid általános sémája
A zsírsavak vizes oldatban eltérően viselkednek. A határfelületi
rétegben úgy rendeződnek, hogy a hidrofil részével a folyadékba merül a
hidrofób része pedig a vízből kifelé áll. Ugyanakkor a folyadék
belsejében is rendeződhetnek (asszociálódnak) micellákat alkotva. A
zsírsavmolekulák úgy rendeződnek, hogy hidrofil részével a víz felé
nézzen.
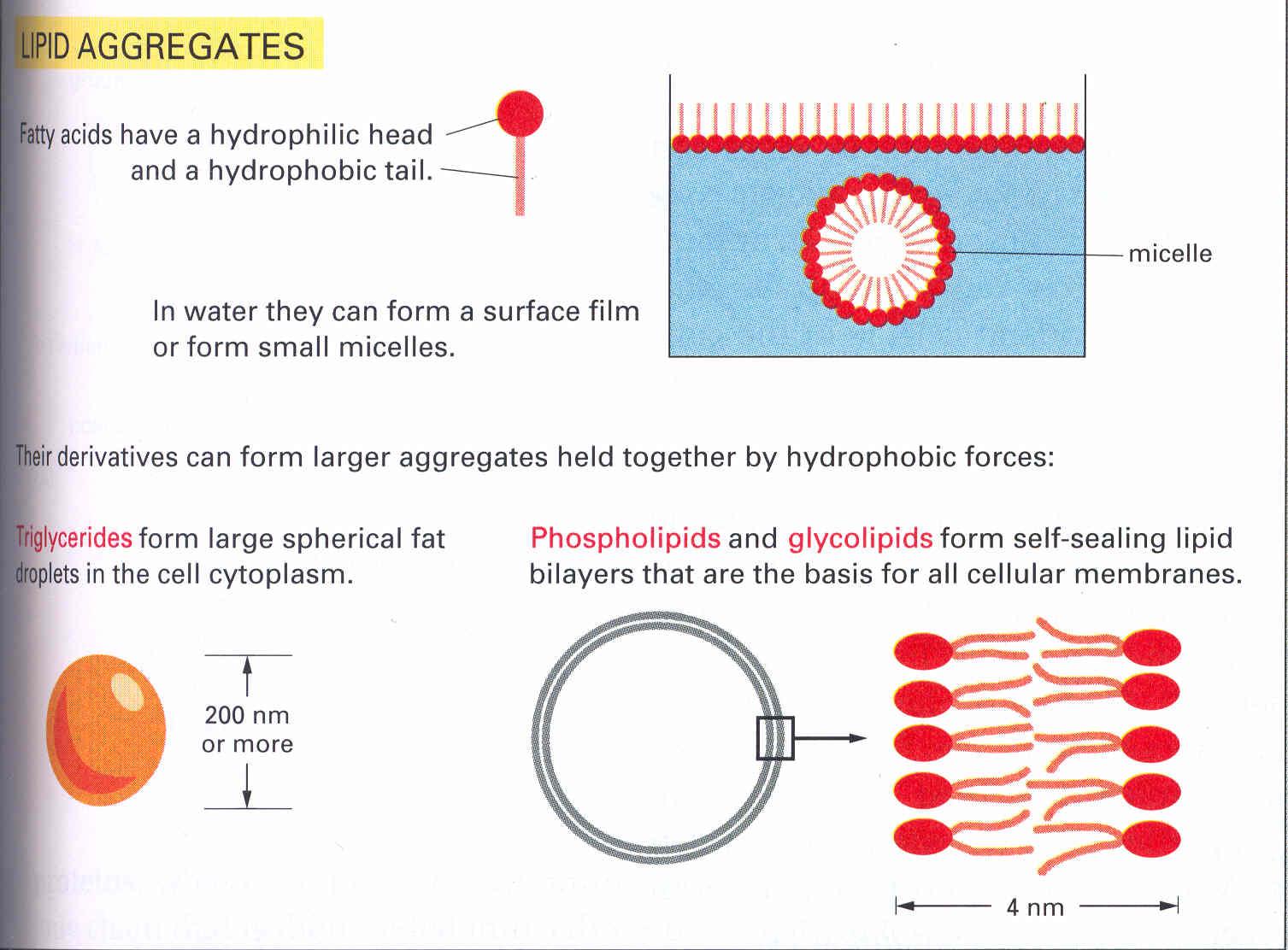
8. ábra Zsírsavak foszfolipidek és glikolipidek rendeződése vizes oldatban.
Vissza
az elejére
Aminosavak, peptidek, peptidkötés
Az aminosavak olyan szerves vegyületek, melyben egy alfa helyzetű
szénatomhoz karboxil- és amin csoport kapcsolódik. Az aminosavak széles
skáláját az adja, hogy a szén másik két kötőhelyeire különböző funkciós
csoport kapcsolódhat (pl. H-,R-,Ar,stb.).
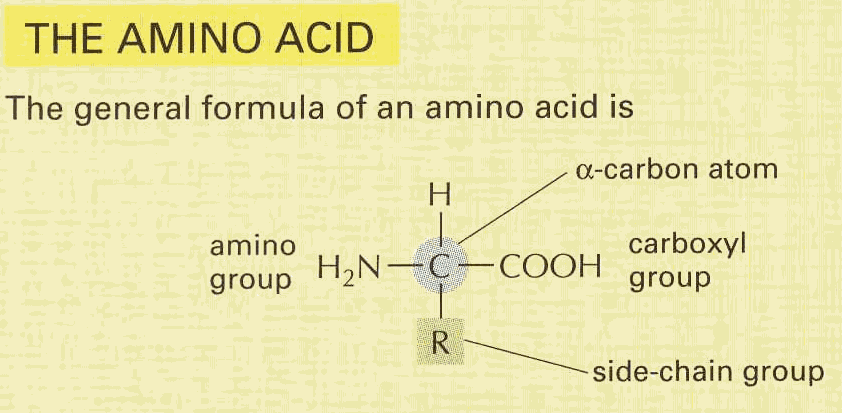
9. ábra Aminosavak általános felépítése
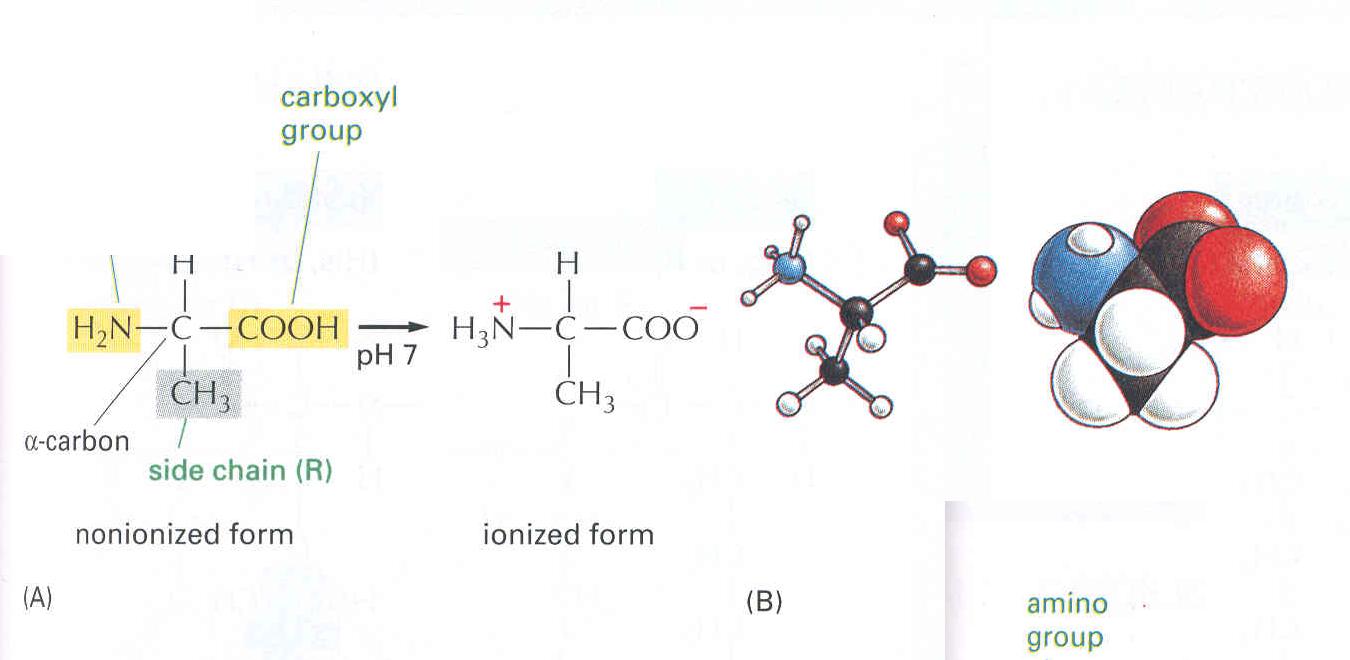
10. ábra Az alanin ikerionos szerkezete vizes
oldatban (pl sejt pH=7)
Ha az aminosavak hosszú polimerláncot
alkotnak peptizáció révén, akkor kialakulnak a fehérjék. A fehérjék
nagyszámú aminosavból felépülő, rendkívül változatos összetételű
makromolekulás anyagok. Jelentőségük az élő szervezet szempontjából
rendkívül nagy: Minden biológiai jelenség összefüggésben van valamilyen
módon a fehérjékkel. Vagyis a fehérjék építőkövei az aminosavak. Az
aminosavak egymással való összekapcsolódása
peptizáció révén alakul ki, a kialakult kötést pedig peptidkötésnek
nevezzük.
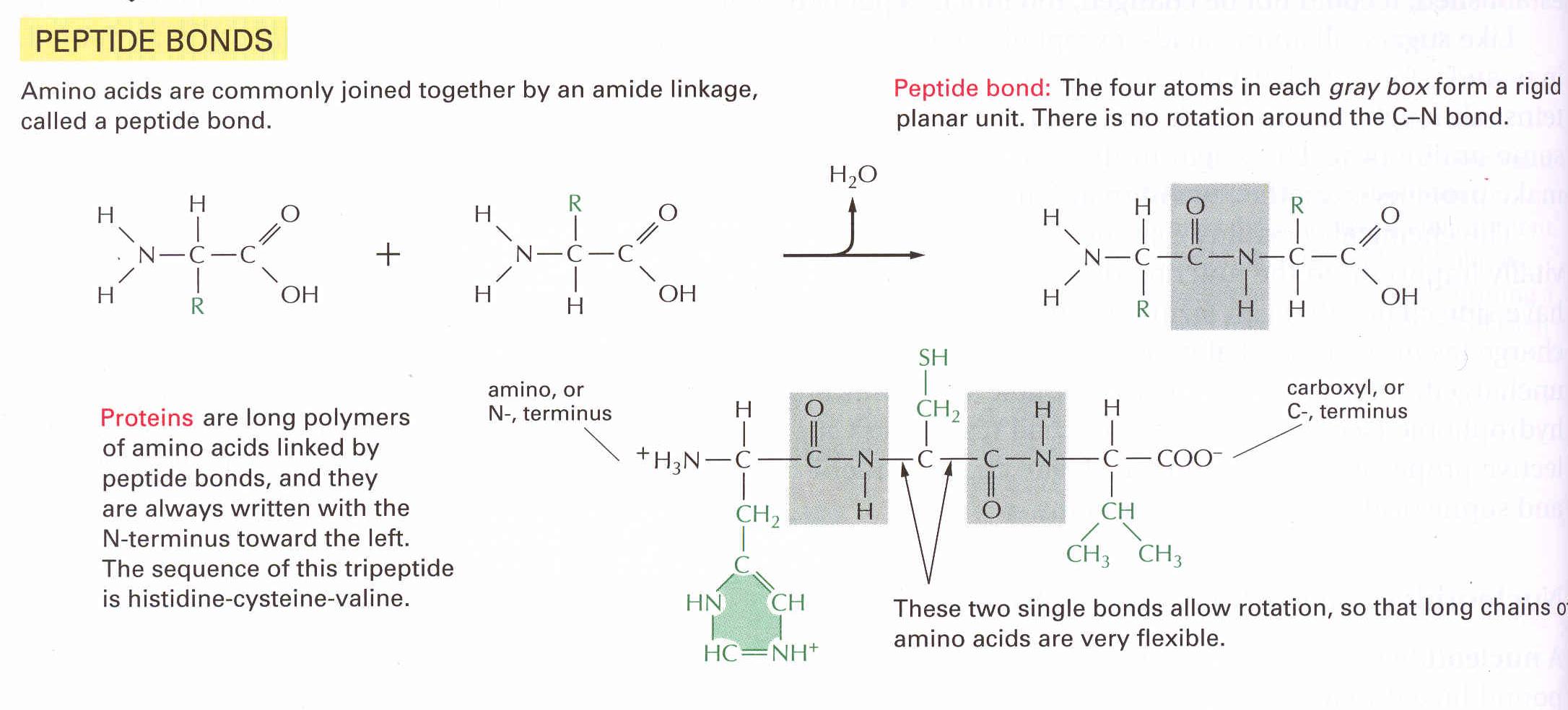
11. ábra peptidkötés kialakulása különböző
aminosavak között
A fehérjéket sokféle szempont alapján
csoportosíthatjuk:
A makromolekula alakja szerint megkülönbözetünk fibrilláris
(fonalszerú) és globuláris (gömbszerű) fehérjéket.
Vissza
az elejére
Membránstrukturák és transzportfolyamatok
Molekuláris biológiai háttér
A sejtet határoló lipid kettősréteg, azontúl, hogy definíálja a sejt
határait, védi azt a külső behatásoktól és mechanikai stabilitást
biztosít neki. A középen elhelyezkedő hidrofób réteg révén az ionokra
és nagyobb poláros molekulákra ez a lipidréteg áteresztő.
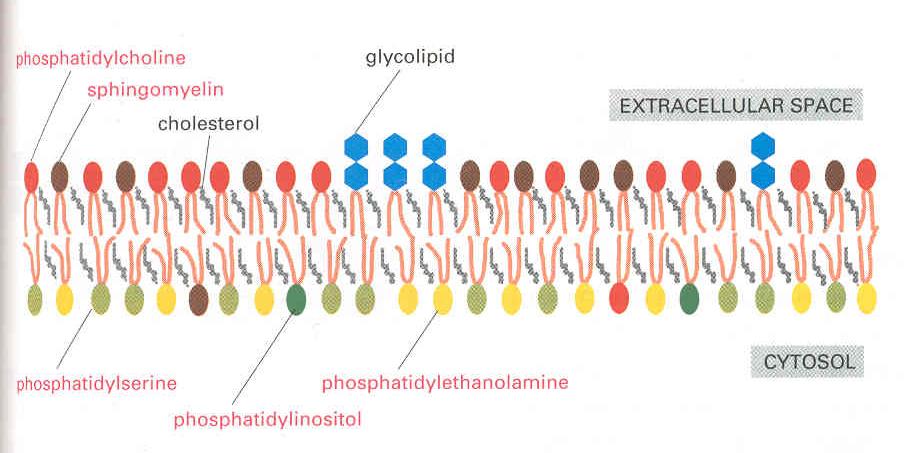
12. ábra plasmamembrán lipid
kettősréteg
Ahhoz, hogy élő sejtről beszélhessünk,
szükség van a sejt és környezete kölcsönhatására: információcseréhez,
anyagtranszportra. Az olyan részecskék transzprotjára, amelyeket a
lipidréteg nem ereszt át, a természet ún. membránfehérjéket alkotott.
Ezek a lipidrétegen keresztültüremkedő óriásmolekulák felelősek sok más
funkció mellett a különböző fiziológiailag fontos szervetlen ionok (Na+,K+,Ca2+,Cl-)
sejtmembránon keresztül való transzportjáért.
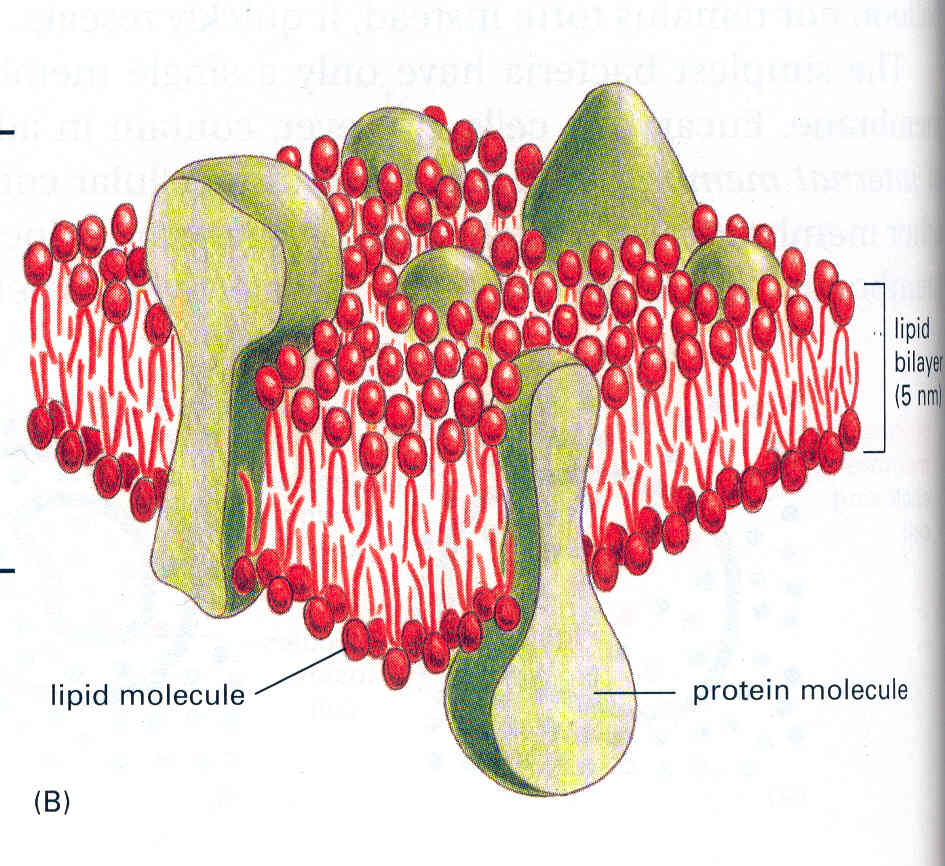
13. ábra sejtmembrán
Szigorúan véve a sejtmemrán a lipidréteg és a membránfehérjék
együtteseként definiálják. A sejtmembrán tömegének mintegy 50%-át a
membránfehérjék teszik ki. A részecskék
továbbítására szolgáló fehérjéket több szempont szerint lehet
csoportosítani. Aszerint, hogy az illető komponens továbbítására annak
elektrokémiai gradiense mentén, vagy azzal szemben történik, passzív
vagy aktív transzportról beszélünk.
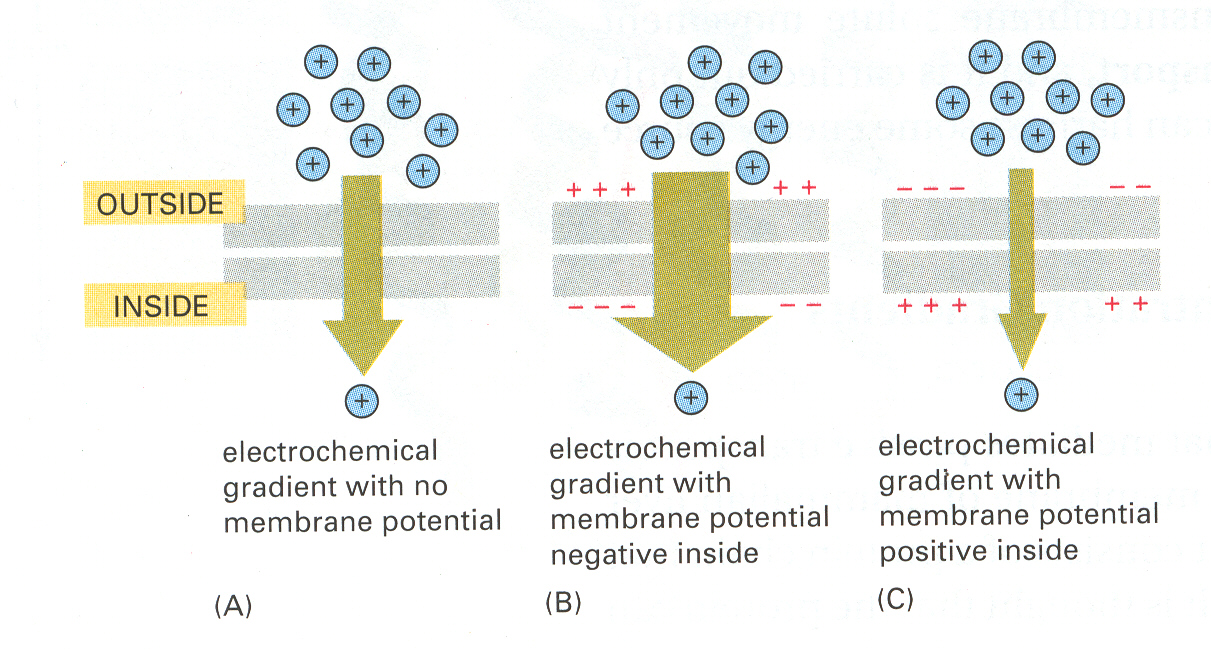
14. ábra elektrokémiai gradiens
Aktív transzport során kémiai vagy fényenergia, illetve egy másik
komponens passzív transzportjának felhasználásával (csatolt transzport)
történik a továbbítás.
Passzív transzport esetén, és ide tartoznak az ioncsatornák is, a
membrán két oldala közt az adott komponensre vonatkozó
koncentrációgradiens, illetve a potenciálkülönbség (ionok esetében)
együttes hatására mozognak a részecskék. Ezt a jelenséget szokás
elektrodiffúziónak nevezni és a Nerns-Planck egyenlet írja le.
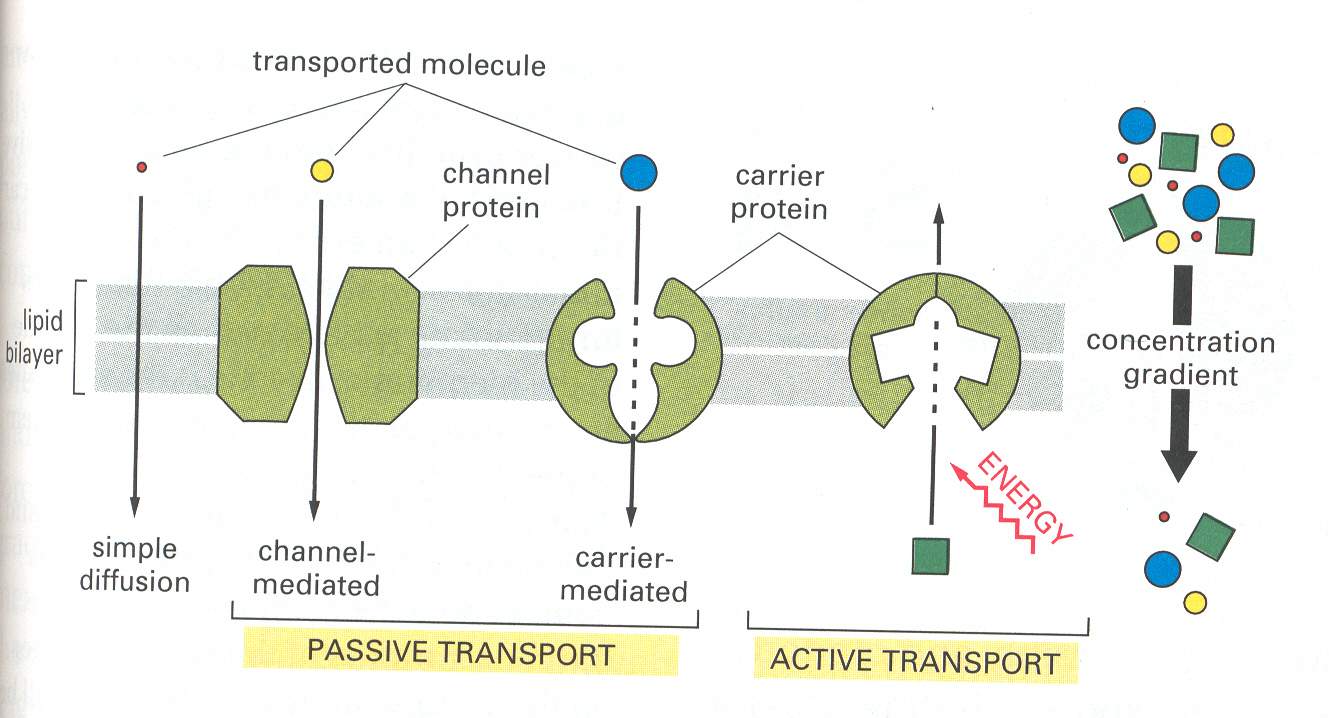
15. ábra aktív és passzív transzport összehasonlítása
Az ioncsatornáknak két nagyon fontos tulajdonságát kell megemlítenünk.
Az egyik, hogy erősen szelektívek, azaz csak egyfajta ionra nézve
áteresztőek, míg a többi ionra nézve nem. Ez
természetesen egy valószínüségi kijelentés, ami azt mondja, hogy a
csatorna azt az ion, amelyre szelektív, nagyobb valószínüséggel engedi
át, mint a többit.
Szelektivitásról természetesen csak nyitott csatorna esetében van értelme beszélni, és ez az ioncsatornák másik alapvető
jellemzője: nyitott vagy zárt állapotban lehetnek, mégpedig
szabályozott módon (gating). A nyitott illetve zárt állapot a fehérje
kétféle kombinációját jelenti. A membrán nyugalmi állapotában a legtöbb csatorna zárt állapotban
tartozkodik (kivételt képeznek a káliumcsatornák). Ahhoz, hogy a
csatorna kinyisson, valamilyen inger szükséges. Ez lehet egy kémiai
jel, amikor valamilyen hírvivő molekula, ligandum, kötődik a
fehérjéhez. Lehet mechanikai behatás, mint
pl. a hallósejtekben.
Itt a feszültségvezérelt (voltage gated) ioncsatornák képezik a
legfontosabb csoportot, mivel ide tartoznak Boda D. és munkatársai
által vizsgált kalcium- és nátriumcsatornák. Itt egy elektromos
ingerület, az ún. akciós potenciál hatására nyit a csatorna.
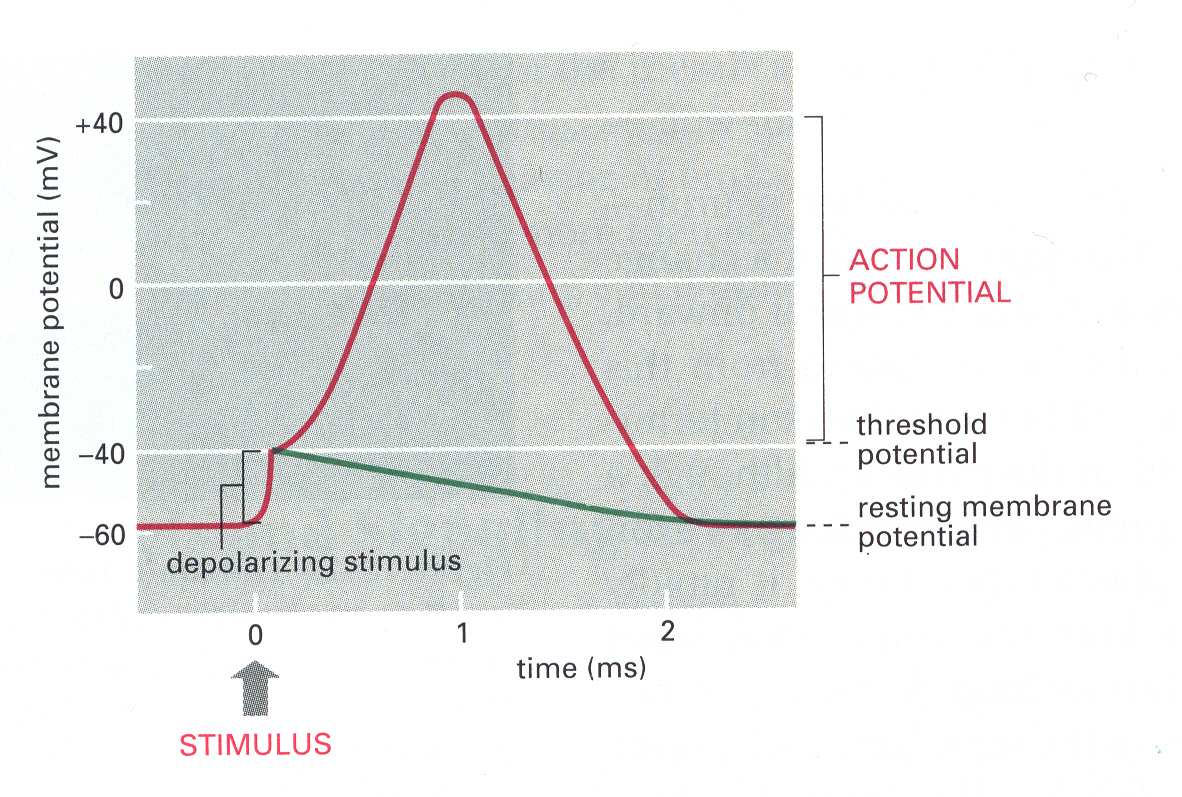
16. ábra Egy akciós potenciál
Ez az akciós potenciál nem más, mint a membránpotenciál hirtelen
megváltozása.
Itt szükséges megemlíteni a kalcium és nátrium csatornák müködését az
idegsejtben. Sok egyéb funkció mellett ezek az ioncsatornák itt játszák
a legfontosabb szerepet. A nátriumcsatornáknak az ingerületnek az
idegrost (axon) mentén való továbbításában van nélkülözhetetlen szerepe.
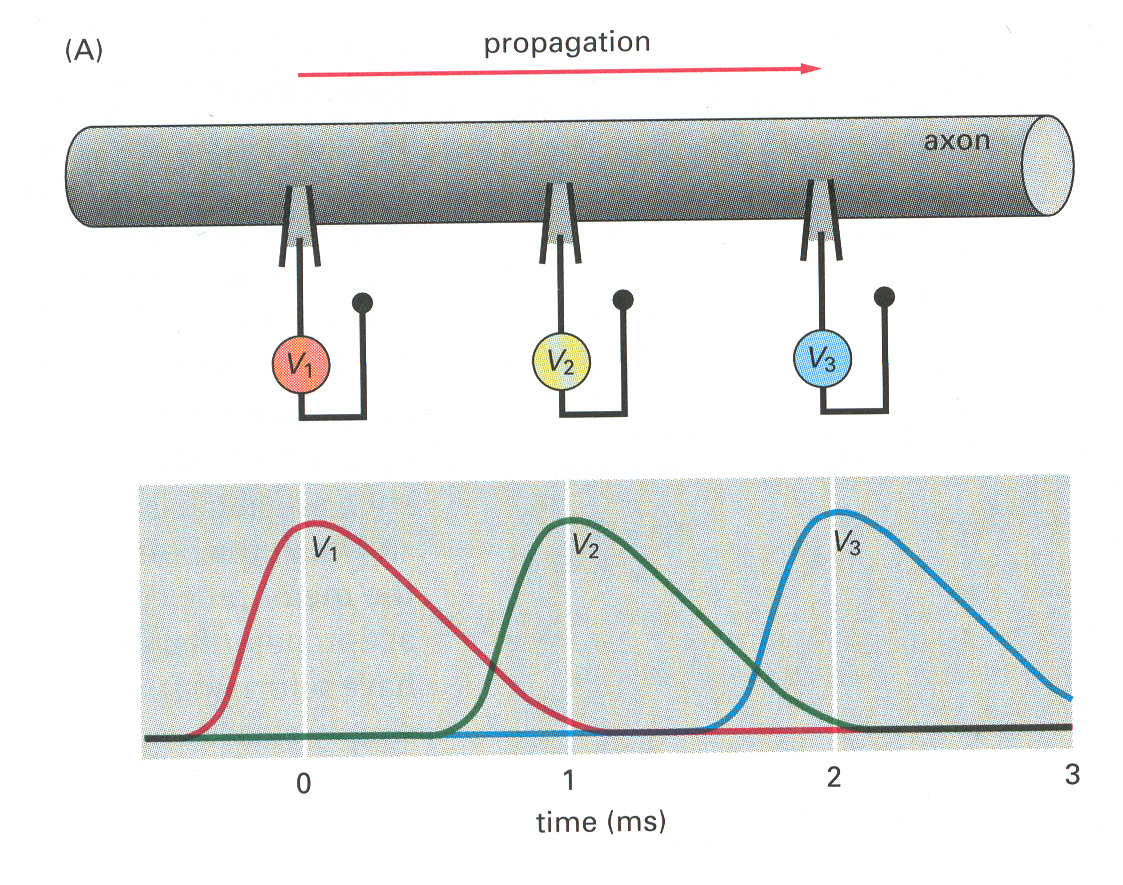
17. ábra axon közötti akciós potenciál
18. ábra akcios potenciál egy
axon mentén
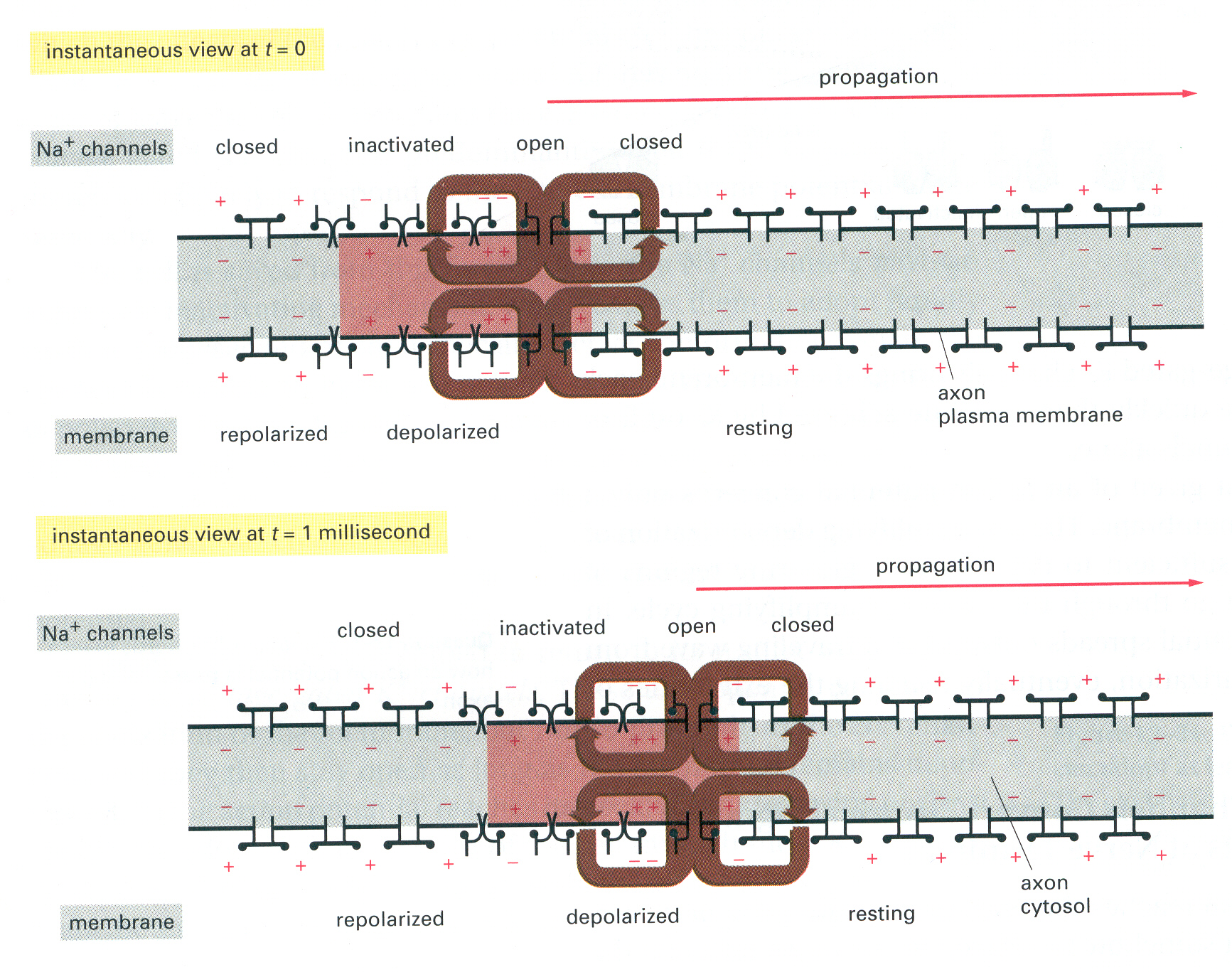
Ehhez azt kell látni, hogy hogyan keletkezik
az akciós potenciál. Ha a sejtmembrán egy adott részére elektromos
inger érkezik, azaz megváltozik a membránpotenciál,
az ott levő nátriumcsatornák kinyitnak. Mivel a nátriumionoknak a
sejten kívül sokkal nagyobb a koncentrációja, és erre a negatív
nyugalmi membránpotenciál csak rásegít, egy nagy, befelé mutató
elektrokémiai gradiens érvényesül a nátriumionokat illetően, ami egy nagy
nátrium-ion fluxust eredményez. Ez az áram viszont megváltoztatja a
nátriumionok koncentrációarányát a membránnak a nyitott
nátriumcsatornák melletti részén, és ezzel együtt a membránpotenciál
is. Ez a potenciálváltozás viszont nyitja az ott levő nátriumcsatornákat. Ez a ciklus az alapja
annak a folyamatnak, melynek során az elektromos ingerület a membrán
felületén, azaz az idegrost mentén továbbterjed, mégpedig
gyengítetlenül. A gyengítetlen tovaterjedéshez szükséges energiát a Na-K pumpák által fenntartott Na+
és K+-koncentrációgradiens biztosítja, végeredményben kémiai energia
felhasználásával.
A kalciumcsatornák akkor lépnek be a képbe, amikor az inger az
idegvégződéshez ér. Ekkor az elektromos inger hatására a
feszültségvezérelt
kalciumcsatornák kinyitnak az idegvégződéseknél, avagy szinapszisnál,
az idegvégződésbe áramló kalciumionok az ún. szinaptikus vezikulákban
tárolt hírvivő molekulák, a neurotranszmitterek felszabadulását
okozzák. Ily módon az elektromos ingerület kémiai ingerületté alakul át. A kémai ingerület a
neurotranszmitter-vezérelt ioncsatornák nyitásával alakul vissza
elektromos ingerületté.
Az ioncsatornák szerkezete
A membránfehérjék pontos szerkezetésről a
tudásunk korlátozott. Egy fehérjemolekula szerkezetét az őt felépítő
aminosavak sorrendje határozza meg. Ezt az aminosavszekvenciát
viszonylag nagy fehérjék esetében is meg tudták határozni, annak
visszafejtése azonban csak kis fehérjék esetében lehetséges. A
membránfehérjék azonban többnyire igen nagy molekulák.
A fehérjék szerkezetének meghatározására használt közvetlen módszer a
röntgendiffrakció. Ehhez azonban ki kell kristályosítani a
fehérjemolekulát. Ez nem könnyű feladat. A membránfehérjék esetében
kiváltképp nem az, mivel ezek a fehérjék egy speciális környezetben helyezkednek el,
középső részüket a lipid kettősréteg hidrofób része veszi körül, míg a
két végük vizes közegben helyezkedik el. Tisztán vizes oldatban a
fehérje más konformációba tekeredhet fel. Erről tanúskodik az, hogy míg
összesen több mint
ezer fehérje szerkezetét sikerült megmérni, az ismert konformációjú
membrán-fehérjék száma csupán néhány tucat.
Direkt és indirekt módszerek segítségével azonban viszonylag átfogó
képpel rendelkezünk az ioncsatornák szerkezetéről. Ezek a fehérjék ún.
alfa-hélix
kötegeknek formájában járják keresztül a membránt, kialakítva így egy
hidrofil pórust, ami az ionok transzportját teszi lehetővé. A KcsA
bakteriális feszültségvezérelt káliumcsatorna azon kevés ioncsatornák
közé tartozik, amelyek szerkezetét röntgendiffrakciós mérésekből ismerjük. Úgy tartják, hogy a
lényeget tekintve a kalciumcsatornák és nátriumcsatornák szerkezete
ehhez nagyon hasonló. Az egyik fő különbség, hogy míg a K csatornánál a
négy alfa-hélix négy különálló fehérjéhez tartozik, addig a Na és Ca csatornáknál azok egy
fehérje alegységei. A másik fő különbség egy a póruson belüli szűk
térrész, a szelektivitást meghatározó szelektív szűrő szerkezetében
rejlik.
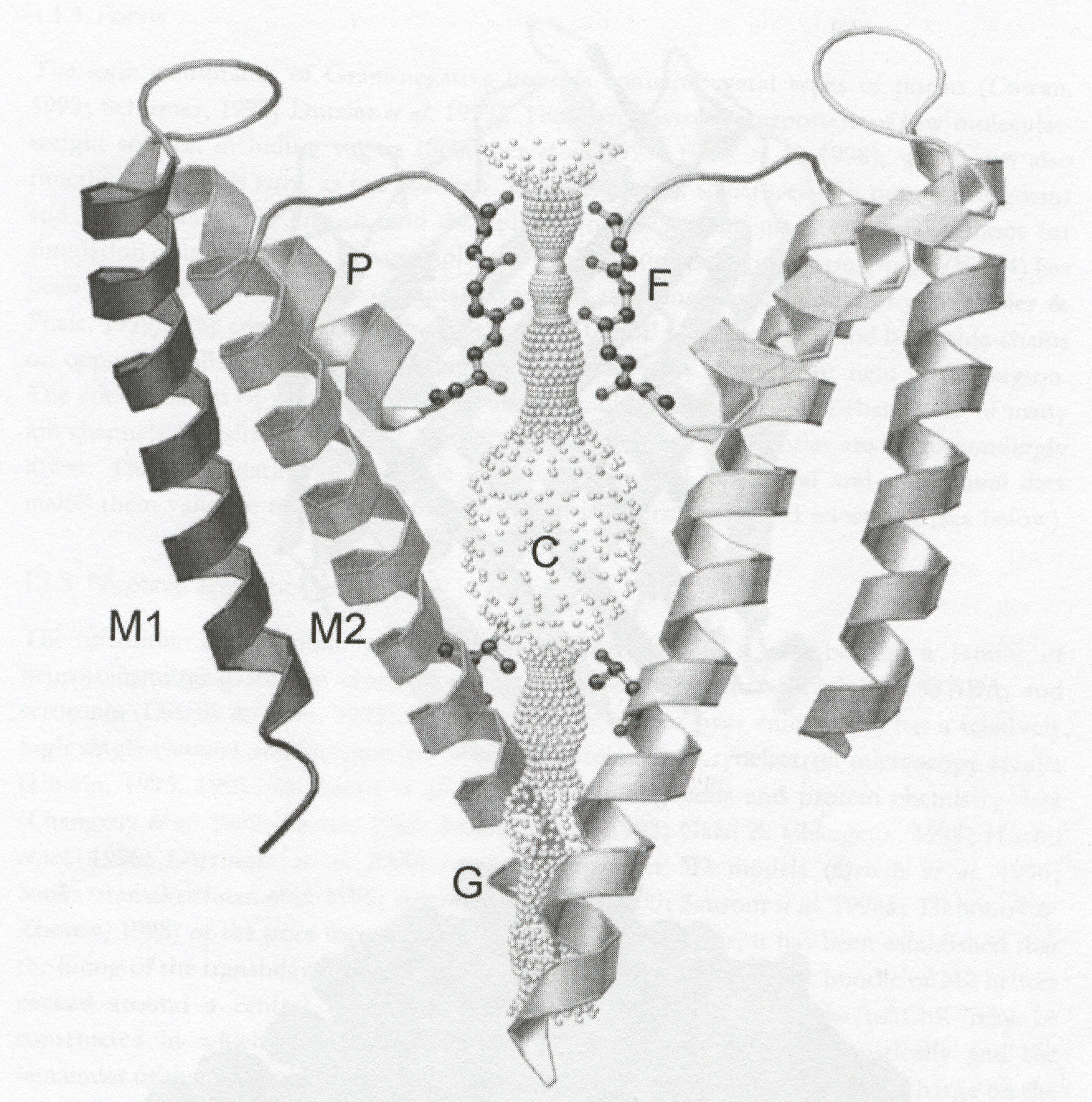
12. ábra A KcsA bakteriális káliumcsatorna vázlatos
szerkezete
Vissza
az elejére
![]() Szerves vegyületek, zsírok,
Zsírsavak, gliceridek
Szerves vegyületek, zsírok,
Zsírsavak, gliceridek![]() Aminosavak, peptidek,
peptidkötés
Aminosavak, peptidek,
peptidkötés![]() Membrán strukturák és
transzportfolyamatok
Membrán strukturák és
transzportfolyamatok![]()

