Fehérjék
A fehérjék igen
változatos felépítésű makromolekulák, amelyek a sejtek szárazanyagának kb. 50%-át teszik ki. Nincs olyan biológiai jelenség, amely
valamilyen módon ne lenne kapcsolatba hozható a fehérjékkel; a fehérjék
kifejezői az élőlényekre jellemző összes sajátságnak, amit a biológiai
információs rendszer tartalmaz. A fehérjék szerkezetét funkciójuk szigorúan
meghatározza.
A fehérjéket feloszthatjuk
aszerint, hogy hidrolízisük során csak aminosavak keletkeznek (egyszerű
fehérjék, proteinek) vagy az aminosavak mellett a hidrolizátum még egyéb
alkotórészt is tartalmaz (összetett vagy konjugált fehérjék). Az egyszerű
fehérjék elemi összetétele átlagosan 50% C, 7% H, 23% O, 16% N és 0–3% S.
Az összetett fehérjék emellett más egyéb alkotórészeket (pl. fémek,
egyéb szerves vegyületek) is tartalmaznak.
A fehérjék szerkezetével a XX. század elején
kezdtek foglalkozni; Emil Fischer kísérletei járultak hozzá leginkább a
fehérjék szerkezetének megismeréséhez. A század elején oldékonyságuk alapján
osztályozva a fehérjéket különböző csoportokat
alakítottak ki:
A globuláris fehérjéknek a tér egyik irányában
sincs kitüntetett méretük, nagyjából gömb alakúak, bennük a polipeptidlánc
tömör gombolyaggá gombolyodott össze. Általában olyan, biológiailag aktív,
dinamikus funkciókat betöltő fehérjék tartoznak ide, mint például az enzimek és
a transzportfehérjék. A statikus feladatokat betöltő fibrilláris fehérjék polipeptidlánca
általában megnyúlt, kettesével, hármasával sodort fonalat alkot. Ez utóbbiak
vizes közegben rosszul oldódnak vagy oldhatatlanok, szerkezeti, mechanikai vagy
védő feladatokat látnak el. Ilyen például a haj, a bőr, a toll, a pata, a köröm
fehérjéje, az α-keratin, az inakat alkotó kollagén vagy a selyemlepke
által készített fibroin. A rendkívül változatos fehérjék igen érzékenyen
reagálhatnak a környezet változásaira. Ha a közeg hőmérséklete nő, ha a pH nő
vagy csökken, ha a közegbe idegen anyagok, például só
kerül, szerkezetük sok esetben felbomlik, irreverzíbilisen elvesztik biológiai
tulajdonságaikat, denaturálódnak. Nagyon lényeges tulajdonságuk, hogy más fajba
jutva ellenanyagképzést indítanak meg; a fehérjék tehát immunaktív anyagok. Az
összetett fehérjék a nemfehérje komponens összetételét illetően is igen
sokfélék lehetnek.
A szervezetben nagy mennyiségben fordulnak elő lipoproteinek,
amelyekben a fehérje lipidekkel kapcsolódik. A transzport lipoproteinek egyik
csoportja a vérplazmában, a bélben és a májban a lipidek szállításában vesz
részt, másik csoportjából lipidtartalmú membránok keletkeznek. A
lipoproteinekben a fehérje és a lipid közötti kapcsolat nem kovalens jellegű.
A glikoproteinekben ezzel
szemben a szénhidrátrész a fehérjével kovalensen kapcsolódik, a szénhidrát a
fehérje integráns része; kapcsolódásuk sokféle kombinációs lehetőség
megvalósítását biztosítja. A glikoproteinek egy részének igen speciális
funkciója van, lehetnek például antigén-determinánsok vagy vírusreceptorok. A metalloproteinek
valamilyen kationt tartalmaznak komplex kötésben, amelynek az esetek
nagyobb részében közvetlen szerepe van a fehérje funkciójának kialakításában.
Peptidek
A peptidek
aminosavakból épülnek fel peptidkötéssel (1. ábra). A részt vevő aminosavak
száma szerint megkülönböztetünk dipeptideket (két aminosav, egy peptidkötés)(2.ábra), tripeptideket (három aminosav, két peptidkötés),
tetrapeptideket. Ha a molekulában tíznél kevesebb aminosav található, akkor
oligopeptidekről, tíznél több aminosav esetében polipeptidekről beszélünk.
Fehérjének akkor nevezzük a polipeptidet, ha az aminosav összetevők száma 100
vagy annál több.
Kötéstávolságok a
peptidkötésben (Å)
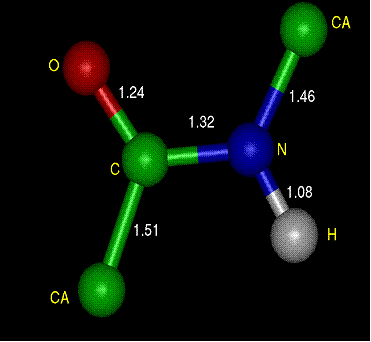
1. ábra. Peptidkötés
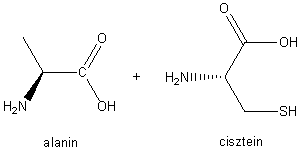
2. ábra. Dipeptid
Két aminosavból,
például glicinből és alaninból, attól függően, hogy az amino- vagy a
karboxilcsoportjával kapcsolódik az egyik aminosav a másik aminosavhoz, kétféle
dipeptid, glicil-alanin vagy alanil-glicin keletkezhet. E két dipeptid
függetlenül attól, hogy mindkettőt ugyanaz a két aminosav alkotja, fizikai és
kémiai tulajdonságaikban lényegesen eltér egymástól. A peptid vagy fehérje
aminosav-sorrendjének leírását mindig azzal az aminosavval kezdjük, amelynek az
NH2-csoportja szabad (N-terminális, aminoterminális) és haladunk a
szabad α-karboxilcsoportot tartalmazó aminosav (C-terminális,
karboxiterminális) felé.
A peptidek
elektrokémiai sajátságait a két terminális szabad amino- és karboxilcsoport és
az oldalláncok ionizáló csoportjai határozzák meg. Minthogy a terminális
csoportok ellentétes töltésű csoportjai peptidkötésben vesznek részt, ezek
elektronszívó hatása a peptidben részt vevő aminosavak számától függően egyre
kevésbé érvényesül.
A természetben
nagyon sok és rendkívül változatos peptid fordul elő. Az izmokban fordul elő a karnozin
(β-alanil-hisztidin) dipeptid, amelynek funkciójáról még nem sokat
tudunk. Sokak által tanulmányozott tripeptid a glutation (γ-glutamil-ciszteinil-glicin).
Két glutation szulfhidrilcsoportja enyhe oxidáció hatására diszulfidkötéssel
kapcsolódhat egymáshoz. A redukált és az oxidált glutation a sejtekben
redoxrendszerként működik. A tripeptid különlegessége, hogy a glutaminsav nem
az α-, hanem a γ-karboxilcsoportjával kapcsolódik a ciszteinhez,
aminek következtében a proteolitikus enzimek nehezebben tudják megtámadni és
lebontani (3.ábra).
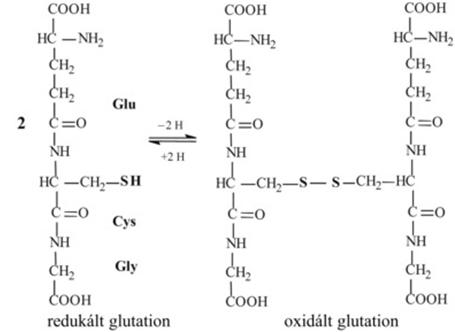
3.ábra. A glutation tripeptid szerkezete
Számos hormon
hatású peptid is ismert, amelyek közül talán legismertebb az oxitocin,
a vazopresszin, az adrenokortikotróp hormon és az inzulin.
Az oxitocin és a vazopresszin felépítésében rendkívül hasonló: egy hattagú
ciklusból és egy háromtagú farokból állnak. Mindkét hormon a simaizmok
működésére hat, azonban a szerkezetükben mutatkozó két aminosav különbség
meghatározza specificitásukat. Az oxitocin a méhizomzat, a vazopresszin a
véredények simaizomsejtjeinek összehúzódását okozza. Az ugyancsak kilenc
aminosavból felépülő, egyenes láncú bradikinin a vérnyomást
szabályozza (4.ábra).
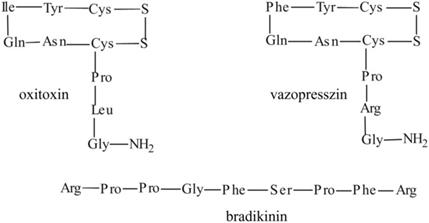
4. ábra. Hormon hatású peptidek
A fehérjék felépítése: elsődleges, másodlagos és harmadlagos
szerkezet
Ha az aminosavak
egymáshoz kapcsolását az előzőekben tárgyalt peptidkötés alapján mindaddig
folytatjuk, amíg a lánc hosszirányában mintegy 100 és 1000 közötti aminosavgyök
helyezkedik el, a fehérjékhez vagy más néven proteinekhez jutunk.
A fehérjék kémiai
felépítése elvben viszonylag egyszerű: peptidkötésekkel számos aminosav
kondenzációja révén jönnek létre. A kialakult szerkezettel kapcsolatban
elsősorban az a kérdés, hogy milyen az egymást követő aminosavak sorrendje,
szekvenciája. Az aminosavszekvenciák a fehérjék elsődleges (primer) szerkezetét
határozzák meg (5.ábra). A szekvencia megállapításával
azonban a proteinkémia feladata még nem ért véget. Könnyű belátni, hogy olyan
hosszú atomlánc, amely több száz aminosavnak molekulává kapcsolódásakor
keletkezik, a térben igen különböző módon alakulhat ki – pl.
mint nyújtott lánc, mint rendezetlen gombolyag vagy mint rendezett spirális. A
láncoknak a térben való elrendeződését lánckonformációnak nevezzük.
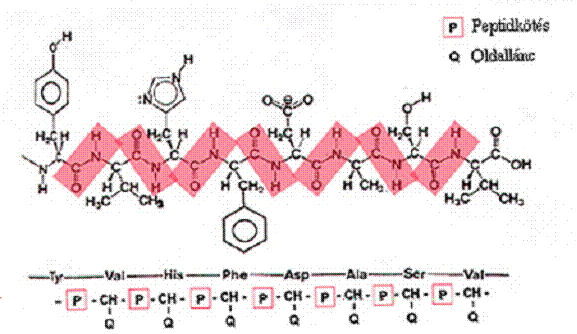
5. ábra. Aminosavszekvencia; a fehérjék
elsődleges szerkezete
A lánckonformáció magába foglalja a régebben használatos
másodlagos (szekunder) és harmadlagos (tercier) szerkezet kifejezéseket, amelyekkel
ezeket a szerkezeti ismertetőjegyeket a szekvenciától
(elsődleges szerkezettől) megkülönböztettünk. A másodlagos szerkezet elnevezés
magának a peptidláncnak a térbeli elrendeződését jelöli, míg a harmadlagos
szerkezet minden atomnak a térben való helyzetére vonatkozik. Végül a
negyedleges szerkezet több peptidlánc meghatározott molekulává történő
aggregációját jelöli.
A másodlagos szerkezet fogalmát nem túl szerencsés módon
választották meg, a fenti meghatározás, amelyben csak nehezen tudtak megegyezni,
eléggé önkényesen határolja el a harmadlagos szerkezettől. Minden esetre a
másodlagos szerkezethez tartoznak a fehérjék elrendeződésének módjai. A
redőzött lemezstruktúrát (β-redő) és az α-spirál (α-hélix)
szerkezetét a 6. ábra szemlélteti.
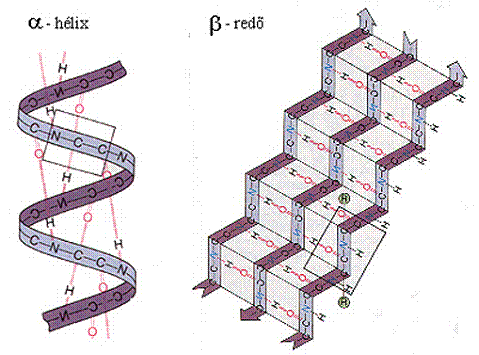
6. ábra. A fehérjék
másodlagos szerkezete
Ha az 5. ábrán bemutatott láncot gondolatban
meghosszabbítjuk, egy nyújtott polipeptidláncot, fibrilláris (szálas
szerkezetű) molekulát kapunk. A hidrogénhíd-kötések akkor alakulhatnak ki, ha
két lánc fekszik egymás mellett. Az ilyen modell azonban az oldalláncok számára
túl kevés helyet biztosít. Ezért Pauling csekély korrekciót alkalmazott, s a
sík „peptidrács”-ot harmonikaszerűen redőzte (6.ábra).
Ezáltal az oldalláncok közel merőlegesen állnak. A modellt redőzött
lemezstruktúrának nevezzük. A fibrilláris proteinek egy részében ez a szerkezet
ismerhető fel. A redőzött modell előnye, hogy egyrészt tekintetbe veszi azokat
a kísérleti tényeket, amelyek szerint az identitási periódus 5-10%-kal
rövidebb, mint ami a nyújtott láncból számítható, másrészt pedig az oldalláncok
számára elegendő teret biztosít. A síkok rendeződésével az is lehetővé válik,
hogy az azonos irányú peptidláncok hidrogénkötései kialakulhassanak. Számolnunk
kell tehát kétféle redőzött struktúra (egy azonos futású, paralel, és egy
ellentétesen futó „antiparalel” lánc) létezésével.
A redőzött struktúrákban vagy „peptidrácsokban” a
hidrogénhíd-kötések különálló láncok között alakulnak ki. Bizonyos esetekben
azonban jobban tükrözi a szerkezetet egy olyan modell, amelyben ezek a kötések
azonos molekulán belül jönnek létre. Ez akkor valósulhat meg, ha a peptidláncot
egy henger körül oly módon csavarjuk fel, hogy menetről menetre a CO- és az
NH-csoportok megfelelő távolságban egymással szembe kerüljenek. Ezen az elven
többféle modell is lehetséges.
A természetben igen elterjedt az α-spirál, amelyben
menetenként 3,7 aminosavgyök foglal helyet, és az azonossági
periódusa mintegy 5,44 Å. Az α-spirál megszerkesztésekor
természetesen figyelembe kell venni, hogy a peptidcsoportok síkban fekszenek és
csupán az α-C-atomon van szabad forgás, tehát itt fordulhat el a lánc. A
metszéspontokban a CO- és az NH-csoportok a hidrogénhíd-kötés távolságában
(vagyis 2,8 Å távolságban) állnak szemben egymással.
Minden aminosavgyök a henger tengelyének irányában 1,47
Å előrehaladást jelent. A hidrogénhíd kötések az egyes menetek között
alakulnak ki, és ez az α-spirálnak különleges stabilitást biztosít.
Oldalláncok a spirálon (amely jobb és bal menetű csavarként
egyaránt felépíthető) a tulajdonképpeni csavartesttől kifelé irányulnak, ezek
egymással vagy az oldószerrel reakcióba léphetnek. Az aminosavak közül a prolin
a spirálba nem illeszthető be. Ott, ahol az aminosavszekvenciában prolin fordul
elő, a szabályszerű szerkezettől eltérés jelentkezik. A fehérjék fent
ismertetett térbeli elrendeződését , a redőzöttséget és az
α-spirál-szerkezetet a peptidkötések atomjai közötti hidrogénhidak
rögzítik.
A proteinmolekulák térbeli alakját tovább vizsgálva azt mondhatjuk,
hogy a lánc meghatározott módon „redőzött”. Valószínű, hogy a redőzöttségnek
ezt a módját már az aminosavszekvencia meghatározza. A redőzés nem
véletlenszerűen jön létre, hanem a peptidlánc különböző szakaszai között
fellépő kötési erők következménye. Amíg ez magát a láncot, vagyis a peptidkötés
atomjait érinti, másodlagos szerkezetről beszélünk.
A globuláris (gombolyag alakú) fehérjékben ezzel szemben
az oldalláncok funkciós csoportjai felelősek a meghatározott redőkért. A 7.
ábrán az oldalláncok között kialakuló kötésfajták láthatóak. Az így kialakuló
alakzatok a fehérjék harmadlagos szerkezetét határozzák meg.
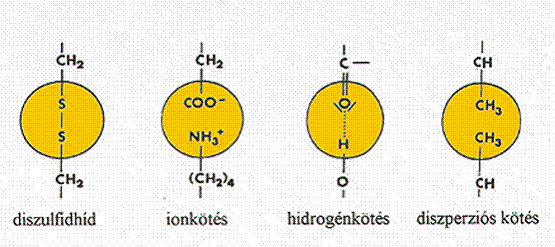
7. ábra.
Az oldalláncok között kialakuló kötésfajták
Diszulfidkötések: Az
aminosav-oldalláncok között létrejövő legfontosabb kovalens kötés a
diszulfidkötés, amely két cisztein-SH csoport között hidrogénleadás
következtében alakul ki. A legtöbb, eddig megismert fehérjében mindenkor
megtalálhatók az egymással meghatározott módon kapcsolódó ciszteingyökök.
Ionos kötések: Létrejöhetnek
pozitív töltésű csoportok (lizin és arginin, kisebb mértékben a hisztidin)
oldalláncai és negatív csoportok (glutaminsav és aszparaginsav oldalláncainak
COO- gyökei) között.
Hidrogénhíd-kötések: A
legfontosabb nem kovalens kötések, amelyek a fehérjemolekula konformációját
biztosítják. Egy karbonil gyök és az NH- vagy OH-csoport protonja között alakul
ki kölcsönhatás, ha ezek mintegy 2,8 Å távolságba kerülnek egymáshoz. A
hidrogénhíd-kötés kötési energiája a kovalens kötésnek csupán mintegy 1/10-ed
része. Minthogy azonban a fehérjemolekulában nagyszámú hidrogénhíd kötés alakul
ki, a hidrogénhíd kötések kötési energiája mégis igen jelentős.
Diszperziós kötések (hidrofób kötések): A nem kovalens kötéseknek egy másik, hasonlóképpen fontos
fajtája azáltal jön létre, hogy a szénhidrogén típusú funkcionális csoportok
(mindenekelőtt a valin, leucin, izo-leucin és a fenil-alanin oldalláncai)
egymáshoz igen közel kerülnek. Ilyen esetben hasonló erők lépnek fel, mint
amelyek bizonyos kristályokban a molekulát összetartják, egyidejűleg pedig a
vízmolekulák ezekről a területekről kiszorulnak. Durva analógiával hasonló ahhoz, mint amikor két kicsiny
olajcsepp egy nagyobb cseppé egyesül. A hidrofób kötések elsősorban a
fehérjemolekulák belsejében fejtik ki hatásukat.
A fehérjék negyedleges
(kvaterner) szerkezete
Az oldott fehérjék, különösen az enzimfehérjék
molekulasúlya 70 000-től több százezerig terjedhet. A fehérjék az esetek
nagy részében több peptidláncból (alegységekből) tevődnek össze, melyek
némelykor diszulfidhidakkal, többnyire azonban csupán gyenge kölcsönhatásokkal
kapcsolódnak össze. Azt a módot, amellyel a teljes molekula az alegységekből összetevődik,
negyedleges szerkezetnek nevezzük. A kvaterner struktúra kialakulását a 8. ábra
szemlélteti.
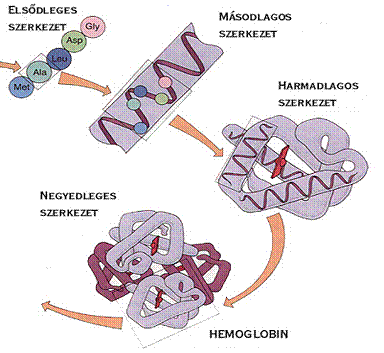
8. ábra. A negyedleges
szerkezet kialakulása
Az alegységekből összetett fehérjék – különösen az
enzimek – teljes szerkezetének konformációját kis molekulasúlyú anyagok gyakran
megváltoztatják; ezt a jelenséget alloszterius hatásnak nevezzük. Különösen jól
tanulmányozott példája ennek a hemoglobinkonformáció változása O2-felvétel
esetén. A hemoglobin deoxi-formája a 9. ábrán, oxi-formája pedig a 10. ábrán
látható. Az alloszterikus hatások elsősorban enzimeknél fontosak. Az
alloszterikus átalakulások több tekintetben a korábbi „konformációs izoméria”
elképzelésnek felelnek meg, amely szerint egy és ugyanazon peptidlánc a térben
különféle görbületekkel fordulhat elő. Ezek a változatos redőzött módosulatok
önmagukban stabilisak lehetnek és különféle biológiai tulajdonságokkal
járhatnak együtt. Valószínű azonban, hogy a különféle konformációkat csak a
járulékosan megkötött molekulák stabilizálják.
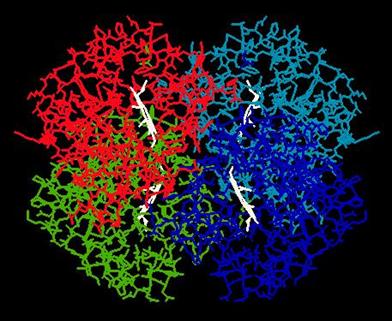
9. ábra. A hemoglobin
deoxi-formája
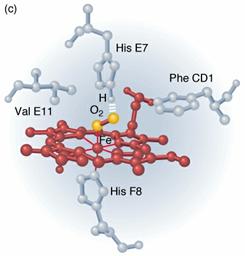
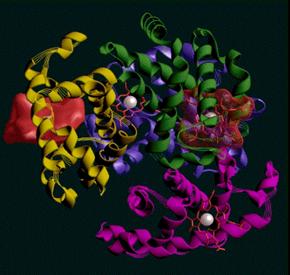
10. ábra. A hemoglobin
oxi-formája
A fehérjék denaturációja
Hő hatására csaknem az összes oldható fehérje koagulál,
ez különösen gyengén savas oldatokban figyelhető meg. A jelenség a
„denaturálás”-nak gyakori (de általában nem szükségszerűen bekövetkező)
ismertető jele. A denaturálás során a fehérje szerkezetében változások jönnek
létre, és ezzel egyidejűleg biológiai tulajdonságai is (pl. enzimatikus vagy
hormonhatás) elvesznek. Oldhatósága erősen csökken, és a kémiai-fizikai
tulajdonságai is megváltoznak. Meghatározott feltételek között a denaturálás
reverzibilisen is előidézhető (11. ábra), többnyire azonban irreverzibilis.
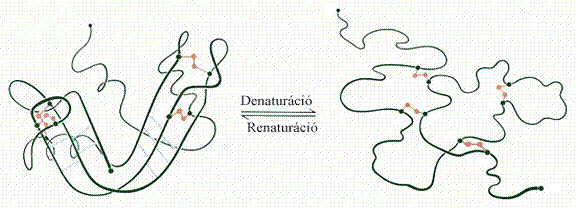
11. ábra. Fehérje
reverzibilis denaturációja
Nagy számú
denaturáló hatású anyag ismeretes, ezekhez tartoznak a savak, a lúgok, az
organikus oldószerek, a koncentrált urea- (karbamid) és guanidinoldat, az
aromás savak, mint a szalicilsav és detergensek, mint a dodecilszulfát. Nem
minden fehérje egyformán érzékeny a denaturálószerekkel vagy a fizikai
behatásokkal, pl. hő- vagy sugárkezeléssel szemben, és az érzékenység különböző
módon függ a pH-tól, a sótartalomtól stb. is.
A denaturálás voltaképpen a nagyobb
rendezettségű állapotból a rendezetlen felé való átmenetnek felel meg. Ez
többek között a nagymértékű pozitív entrópiaváltozással is bizonyítható. A
denaturáció erősen endoterm folyamat, azonban bizonyos kritikus hőmérsékleten
felül mégis exergonikus folyamat.
A jelenség
ily módon az olvadás folyamatának felel meg, és ez az analógia nem csupán
felszínes. Mint ahogyan az olvadás esetében a kristály térrácsa összeomlik, a
denaturálásnál éppen úgy bomlanak fel a gyenge kötőerők, amelyek a globuláris
fehérjéket a natív konformációban stabilizálják. A peptidláncok legombolyodnak
és a láncok között tisztán véletlenszerűen alakulnak ki gyenge kötések, miáltal
a fehérje oldhatatlanná válik. Másrészt számos csoport (pl. SH-csoport vagy
tirozingyök), amely előzetesen a molekula belsejében rejtve és „maszkírozva”
volt, most kifelé fordul és reakcióképessé válik. A denaturált fehérjéket a
proteáz enzimek könnyebben támadják meg, mint a natív proteineket.
A fehérjék molekulatömege
Az előző fejezetek alapján világossá válik, hogy a
fehérjemolekula fogalma nehezen definiálható. Egyszerű a probléma, ha a fehérje
csak egy polipeptidláncból áll, de bonyolultabb a helyzet az oligomer
felépítésű fehérjéknél. Ezen utóbbiak többsége neutrális pH-n, kis ionerősség
mellett egységes molekuláknak mutatkozik, a körülmények megváltozása (alacsony
vagy magas pH-n, tömény karbamid, detergensek) esetén azonban kisebb egységekre
disszociál.
A
molekulatömeg meghatározásának többféle módszere ismert. A fehérjék
molekulatömegét az Mr relatívmolekulatömeg-értékkel jellemezzük, ami
viszonyszám, ezért dimenziómentes. Azt jelenti, hogy az illető fehérje tömege
hányszorosa a molekulatömeg-számítás alapját képező 12C tömege
1/12-ed részének. A molekulatömeget meghatározó módszerek csak hozzávetőleges
eredményt adnak. Pontos értéket csak akkor kaphatunk, ha megismerjük a fehérje
aminosav-sorrendjét és az aminosavak molekulatömegének segítségével kiszámoljuk
a fehérje pontos Mr-értékét.
A fehérjék oldhatósága
Az egyes
fehérjék oldhatóságában jelentős eltérések mutatkoznak, amelyek egyrészt a
hidrofil és a hidrofób csoportok eltérő számából és térbeli elrendeződéséből,
másrészt a molekula nagyságából, alakjából és az oldószer minőségéből adódnak.
Az oldhatóság alapján megkülönböztetünk oldódó és nem oldódó, csak duzzadó
fehérjéket. A fehérjék csak poláros oldószerekben oldódnak, mint pl. a víz, a
glicerin, a hangyasav. Az oldódás azáltal következik be, hogy az
oldószer-molekula jellegzetes kölcsönhatást alakít ki a fehérjével. Ehhez
szükséges az, hogy kellő számú poláros csoport legyen a fehérjemolekulában; a
molekulában lévő diszulfidhidak viszont az oldhatóságot jelentős mértékben
csökkentik, ami magyarázza, hogy miért nem oldódnak a viszonylag nagy
kéntartalmú fehérjék. Duzzadási folyamat indulhat meg olyan fehérjéknél,
amelyekben sok szabad karboxil- és aminocsoport található, ezekhez ugyanis a
poláros oldószerek elektrosztatikus kötőerőkkel kapcsolódhatnak. Az oldószer
ionerősségének növelésével az oldhatóság nő. Semleges sók kis koncentrációban
növelik az oldhatóságot, azonban egy meghatározott koncentráción túl az
oldhatóság csökken, és bekövetkezhet a fehérje kicsapódása.
A fehérjék elektrokémiai tulajdonságai
A fehérjék elektrokémiai
tulajdonságait a felépítő aminosavak hasonló karaktere határozza meg,
ezért a fehérjék amfoter jellegűek. Poliionoknak tekinthetők, amelyek töltésjellegét
és mennyiségét a rendszer pH-ja jelentősen befolyásolja. Izoelektromos pontnak azt a
pH-t nevezzük, ahol a pozitív és negatív töltések száma azonos, tehát a fehérje
semleges molekulának tekinthető. Ezen a pH-n a fehérjék elektromos erőtérben
sem a pozitív, sem a negatív pólus felé nem mozdulnak el. Az izoelektromos ponton a legkisebb a fehérje
oldhatósága, legnagyobb a kicsapódási hajlama, a kisózódási és a
kristályosodási lehetősége. A fehérjeoldatok viszkozitása az izoelektromos
ponton a legkisebb.
Felhasznált irodalom:
P. Karlson, Biokémia,
Medicina Könyvkiadó, Budapest (1972)
J. Csapó, Zs. Kiss,
Tej és tejtermékek a táplálkozásban, Mezőgazda kiadó (2002)