Membránstruktúrák,membránfehérjék
Kripli Balázs
Membrán struktúrák
A biológiai membránok kulcsfontosságú
struktúrákat alkotnak a sejtekben:
1. A sejteket plazmamembrán határolja és alapvető szerepet játszik abban, hogy a
sejtek belső összetétele eltér a környezetük összetételétől.
2. Eukarióta sejtekben pedig belső membrán struktúrák (ER, Golgi,
mitokondrium stb.) is vannak, aminek következtében az organellumok és a citoszól
eltérő összetételűek.
Minden biológiai membránnak egységes, általános struktúrája van
(kivéve: ősbaktériumok membránja): nem kovalens kölcsönhatásokkal összetartott
lipidekből és fehérjékből álló vékony film. A lipidek a biológiai membrán
alapvázát a fehérjék pedig a specifikus tulajdonságokat biztosítják.
A biológiai membránt alkotó lipidek amfipatikus molekulák
A lipidek nem oldódnak vízben csak szerves
oldószerben. A lipidek amfipatikus molekulák
és ez a görög szó azt jelenti, hogy "mindkettőt tolerálja". A
molekula egyik vége (fej) hidrofil (poláros), a másik vége (farok) pedig
hidrofób (apoláros).
A biológiai membránban foszfolipidek fordulnak elő, melyek az alábbi két részből épülnek
fel:
1. poláris
fej rész
|
|
2. két
darab hidrofób szénhidrogén lánc (farok).
Az alapvegyület a foszfatidsav, ami egy glicerin molekula két zsírsavval
észteresítve, amihez még egy foszforsav is kapcsolódik. A molekula “farka”
leggyakrabban 14-24 szénatomszámú zsírsavakból áll. Az egyik zsírsav általában
egy vagy több cisz kettős kötést
(telítetlen zsírsav) tartalmaz, és emiatt a szénhidrogén lánca megtörik.
A lánchossz és a telítettség fontos, mert
befolyásolják a foszfolipidek összepakolhatóságát (ld. membrán fluiditás).
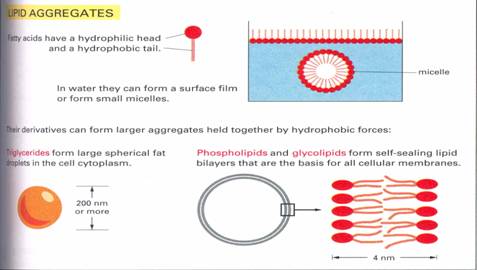
A foszfolipidek viselkedése vízben
Ha a foszfolipideket víz veszi körül, akkor
aggregálódnak, úgy, hogy a hidrofób ‘farkaik’ belülre kerülnek, a ’fej’ pedig a
víz felé néz. Alapvetően kétféle struktúrát képezhetnek vizes oldatban (ld.
2-2. ábra), attól függően, hogy:
|
|
·
milyenzsírsavak vannak bennük
·
milyen a hőmérséklet
·
milyen ionok vannak jelen és 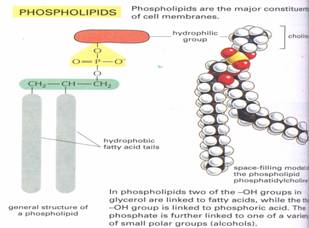
·
milyen a diszperzió módja:
1. gömb alakú micella: Foszfolipid sémája
20 nm-es átmérőjű.
2. kettős réteg (bilayer).
Ha a lipid bilayer szabad vége vízzel nem
érintkezhet, mert az termodinamikailag instabil, ezért azt eliminálni igyekszik
(önhegedő tulajdonságú). A lipid
kettős réteg zárt kompartmentet alkot, amit liposzómának nevezünk. Ha a kettős réteget elszakítjuk, akkor visszaheged,
ami a spontán képződési tulajdonságából is következik. A lipid kettős réteg önhegedő tulajdonsága ideális a
biológiai membrán képzéshez.
A lipid kettősréteg (bilayer) sémája
A lipid kettős réteg
|
|
A lipidek a biológiai membránokban kettős
réteget alkotnak és ez a biológiai membránok általános struktúrális alapja.
Evidenciák a foszfolipid kettős rétegre:
1. Gorter és Grendel
humán vörösvértest (eritrocita) lipidjeit víz felszínére kiterítve azt
tapasztalták, hogy unimolekuláris film keletkezik. A monolayer felszínét az
eritrocita felületének kétszeresének
találták. Mivel az eritrocitában nincsenek belső membrán struktúrák, ezért ez
azt bizonyította, hogy a sejtmembránja egy lipid kettős réteg (bilayer).
|
|
2. Elektronmikroszkópiában
alkalmazott ozmium-tetroxidos festés a lipidek
“fejéhez” kötődik. A keresztvágással készült vékony metszeten a
sejtmembrán úgy néz ki, mint egy vasúti sín.
3. Az
idegsejt Schwan-sejt membránjából kialakult mielin hüvelyén végzett
röntgen-diffrakciós anyagsűrűség vizsgálat a 2-3. ábrán látható képet
szolgáltatja.
4. Fagyasztva töréses
elektronmikroszkópiás eljárás is bizonyítja, hogy sejtmembránban a lipidek
kettős réteget alkotnak.

A sejtmembrán
A lipid kettős réteg egy két-dimenziós folyadék
Zsírsavak,foszfolipidek,glikoklipidek
rendeződése vizes oldatban
|
|
Csak az 1970-es években ismerték meg a lipid
molekulák viselkedését a lipid kettős rétegben és a biológiai membránokban.
Először szintetikus lipid kettős rétegeket használtak a vizsgálatokhoz. A
gyakorlatban kétféle szintetikus membránt szokás használni (ld. 2-4. ábra):
1.
liposzómák: a kettős réteg gömbalakot ölt, aminek átmérője
25 nm és 1 µm között változhat.
2.
planáris bilayerek ("fekete membránok"):
két vizes fázist elválasztó lukra húzzák fel a kettős réteget.
Az egyedi lipidmolekulák mozgásának mérésére
az elektronspin-rezonancia (ESR)
használható, ha rendelkezünk egy párosítatlan elektront tartalmazó (pl. nitrozil
csoport = N-O) vegyülettel. Ennek megfelelően lipidek a fej részében ilyen, ún.
“spin jelölést” alkalmaznak és mérik a mobilitásukat a membránban.
A mérések alapján megállapítható volt, hogy:
|
|
1. A
lipidek csak nagyon ritkán (havonta csak egyszer) ugranak az egyik rétegből a
másikba. Az egyik rétegből a másikba való ugrást flip-flop-nak nevezzük, ami tehát termodinamikailag nem
kedvezményezett.
2. Ezzel
szemben a szomszéd lipid molekulákkal másodpercenként átlagosan 107-szer
helyet cserélnek (laterális diffúzió). Ez a szám egy 10-8 cm2/sec
diffúziós együtthatót szolgáltat, ami azt jelenti, hogy a lipidek 2 µm / sec
sebességgel diffundálnak a membrán egyik rétegében (emlékezzünk, hogy a
baktérium sejt hosszára: kb. 2 µm).
3. a
longitudinális tengelyük körül pedig
folyamatosan forognak (rotáció).
Hasonló kísérletek történtek izolált membránokkal és egyszerű intakt sejtekkel (mikoplazmák,
baktériumok és vörösvértestek) is. Ezen kísérletek olyan eredményekre vezettek,
mint a szintetikus membránnal végzett vizsgálatok. Mindezek alapján megállapítható,
hogy a lipid kettős réteg úgy viselkedik, mint egy két dimenziós folyadék: a lipid molekulák a folyadék
halmazállapothoz hasonló sebességgel szabadon diffundálnak és forognak, de csak
az adott rétegben, vagyis mozgásuk két dimenziós. Mivel a lipidek gyakorlatilag
nem lépnek át a másik rétegbe, ezért szintetikus membránokban a lipid molekula
az egyik rétegbe van “zárva”.
Mivel a lipid molekulák nem tudnak átugrani az
egyik rétegből a másikba (flip-flop), ezért felvetődik a kérdés, hogy az élő
sejtek miként növelik a membránjaik felületét, hiszen a sejt által újonnan
szintetizált lipid molekulák nyilvánvalóan a belső rétegbe épülnek be? A sejtek
számára a foszfolipid transzlokátor (flippáz) nevű enzim jelenti a megoldás, ami a lipid molekulák egy részét
(felét) átviszi a másik rétegbe.
A kettősréteg fluiditása az összetétel függvénye
|
|
A membrán fluiditás nagyon fontos a
membrán-folyamatokhoz: hűtésre a membrán viszkozitása megnő, és a
transzport-folyamatok leállnak. A fluiditás a lipid összetétel és a homérséklet
függvénye. Szintetikus lipid membránokon végzett kísérletek szerint az egyféle
foszfolipidből álló kettősréteg folyadék állapotból kristályos (gélszerű) állapotba megy át egy
jellegzetes fagyásponton és
fordítva: hő hatására a gélszerű állapot folyadékszerűvé alakul Ez a hirtelen változás (fázis átmenet) egy szűk homérséklet
tartományban következik be.
A rövidebb és telítetlen zsírsavakat
tartalmazó membránokat nehezebb fagyasztani (alacsonyabb a fagyáspontjuk), mert
a rövidebb és merevebb láncok között gyengébbek a Van der Waals erők, ezért
nehezebben lépnek egymással kapcsolatba.
Mivel a membrán fluiditás esszenciális a
membrán folyamatok fenntartásához, ezért a váltakozó hőmérsékleten tartózkodó
sejtek szabályozzák membránjaik lipid összetételét a hőmérsékletfüggvényében a
membrán fluiditás közel állandó értéken tartása érdekében. Hőmérséklet
csökkenés esetén több telítetlen zsírsavat építenek a membránjaikba, ezért az
fluidabb lesz alacsonyabb hőmérsékleten is.

Transzmembrán
α-hélix szerkezet
A koleszterin hatása a membrán fluiditásra
|
|
Sok eukarióta sejt plazmamembránja koleszterint
tartalmaz, aminek mennyisége elérheti a foszfolipidét. A koleszterin interkalál
a foszfolipidek közé, úgy hogy hidroxil csoportja a lipidek poláris fejével van
kölcsönhatásban, rigid szterán váza pedig immobilizálja a szénhidrogénláncok
azon részeit, amik a fejhez közelebb esnek. Ennek következtében a gátolja a
lipidek mozgását a membránban és kevésbé fluiddá teszi a membránt. Jóllehet
kevésbé fluiddá teszi a membránt, mégis gátolja a membrán fázisátmenetét is,
mert a lipidek szénhidrogénláncai nehezebben tudnak kölcsönhatásba lépni az
alacsonyabb hőmérsékleten.
A lipid összetétel változik az élovilágban
|
|
A különböző biológiai membránok lipid
összetételéről a következőket érdemes megjegyezni:
1. Baktériumokban
általában egy alapvető foszfolipid van és ez foszfatidil-etanolamin. Soha nincs
koleszterin. A baktérium membránnak nem kell merevnek lennie, mert a mechanikai
stabilitást a sejtfal biztosítja.
2. Emlős
sejteknél a membrán összetétel sokkal változatosabb. A koleszterin mellett
alapvetően az alábbi négy féle foszfolipid fordul elő:
n
foszfatidil-szerin
n
foszfatidil-kolin
n
foszfatidil-etanolamin és
n
szfingomielin.
A foszfatidil-szerinnek negatív töltése van,
míg a többi foszfolipid semleges fiziológiás pH-n (a foszfát negatív, míg az
amino-csoport pozitív töltésu). Ez a négy foszfolipid adja membránlipidek több
mint felét.
A fenti négy foszfolipid mellett van még
foszfatidil-inozit is, de sokkal kevesebb, mert a szignál képzésben van alapvető
szerepe.
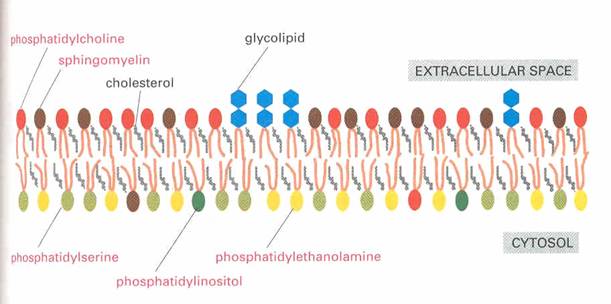
A lipid kettős réteg aszimmetrikus
|
|
Az eddig vizsgált biológiai membránokban a két
réteg lipid összetétele alapvetően eltérő.
A vörösvértest membránban pl.:
1.
minden lipid molekula, amiben kolin van
(foszfatidil-kolin és szfingomielin) a külső rétegben van (exoplazmás réteg).
2.
a terminális NH2
csoportot tartalmazó lipidek
(foszfatidil-etanolamin és foszfatidil-szerin) pedig a belső rétegben.
Mivel a negatív töltésű foszfatidil-szerin
mindig a belső rétegben van, ezért elektromos potenciálkülönbség van a két
réteg között.
A lipid eloszlás aszimmetriája a foszfolipid transzlokátor (flippáz) hatásának
következménye, ami a foszfolipideket az egyik rétegből a másikba áthelyezi,
ugyanis a flippáz válogat és csak bizonyos foszfolipideket helyez át a külső rétegbe,
másokat viszont a belső rétegben hagy.
A plazmamembrán külső felületét glikolipidek borítják
A glikolipidek (szénhidrátot tartalmazó
lipidek) mutatják a legjellegzetesebb aszimmetriát. Szinte kizárólag az
exoplazmás oldalon helyezkednek el, ahol mikroaggregátumokká asszociálódnak
hidrogén-kötések révén. A cukor részük mindig a sejtfelszínen található. Az
aszimmetria annak következménye, hogy a cukorrész a Golgi lumenjében (ami a
sejt környezetével ekvivalens) adódik a lipidhez. Glikolipidek valószínűleg
minden állati sejt membránjában vannak és a külső réteg lipidjeinek 5%-át
teszik ki.
|
|
A legkomplexebb glikolipidek a gangliozidok: oligoszaharidokat
tartalmaznak és 1-2 szialinsavat (N-acetil-neuraminsav), ami mindig negatív
töltést ad a molekulának. Sok van az idegsejt membránban (10%-a a lipideknek).
Membránfehérjék
A lipidek adják a biológiai membránok alapvető
struktúráját és impermeábilis tulajdonságát, az összes többi speciális
tulajdonság pedig a membránfehérjék következménye.
A fehérjék mennyisége és típusa szerint a
membránok alapvetően különböznek:
n
mitokondrium belső membránjában a
membrán össztömegének 76%-a protein.
n
az idegsejtek mielin membránjában viszont
csak 18% a protein van az elektromos szigetelés miatt.
n
egy átlagos citoplazmamembrán fehérje
tartalma pedig a fenti két érték közé esik vagyis kb. 50% proteint tartalmaz.
A membrán-lipidekhez hasonlóan a proteineknek
is lehet oligoszaharid lánca (glikoproteinek). Így a sejtfelszín (sejtburok) alapvetoen szénhidrátokból
áll (glycocalyx vagy cell coat).
A membránproteinek a lipid kettős réteggel különbözőképpen
léphetnek kapcsolatba
|
|
Az egyes fehérjék különbözőképpen lépnek
kapcsolatba a membránnal:
1.
Integráns membránfehérjék: szoros kapcsolatban
állnak a lipid kettős réteggel:
transz-membránfehérjék:
áthatolnak a membránon
úgy, hogy annak mindkét oldalán kilógnak. Egyszer vagy többször is átszelhetik
a membránt. Amfipatikusak, akárcsak a membránt alkotó lipidek:
1. a hidrofób aminosav oldalláncaik a
foszfolipidekkel lépnek kölcsönhatásba,
2. a hidrofil részeik pedig a membránt
körülvevő vízzel.
A membránfehérje hidrofóbicitását kovalensen
kötött lipidek is növelhetik. Hogy milyen lipid kapcsolódik kovalensen a
membránfehérjéhez az attól függ, hogy a lipid a membrán melyik rétegével lép
kölcsönhatásba:
Azok a fehérjék, melyek a membrán citoplazmás
oldalával lépnek kapcsolatba a lipiden
keresztül vagy
1. 14 szénatomszámú,
telített zsírsavat (mirisztinsav) tartalmaznak, ami az N-terminálisú glicinhez kapcsolódik
(pl. v-src) vagy
2. más szénhidrogén
láncot (farnezil-csoport), ami a C-terminálishoz közeli ciszteinnel köt (pl.
ras fehérjében).
|
|
Ezek a fehérjék a citoszólban, mint oldható
fehérjék szintetizálódnak és csak a lipid hozzákapcsolását követően
irányítódnak a membránba.
Azok a fehérjék, melyek a membrán külső
(exoplazmás) felszínével lépnek
kölcsönhatásba lipid molekulán keresztül mindig foszfatidil-inozithoz kapcsolódnak
kovalensen oligoszaharidon keresztül. Ezek a fehérjék mint transzmembrán
fehérjék keletkeznek az endoplazmás retikulumban, de a transzmembrán rész még
ott levágódik és egy glikozil-foszfatidil-inozitol csoport adódik hozzájuk és ez köti őket az exoplazmás oldalra. A
foszfolipáz-C enzim hasítja a glikozil-foszfatidil-inozitol csoportot, és ezek
a fehérjék így könnyen felismerhetők.
2.
Perifériális membránfehérjék (extrinsic fehérjék): nincsenek
közvetlen kapcsolatban a foszfolipid kettősréteg hidrofób részével. Általában
az integráns mebránfehérjék által vannak a membránhoz kötve nem kovalens
kötések révén. Ezek a fehérjék gyengéd eljárásokkal (nagy vagy alacsony ionerősség,
extrém pH) is felszabadíthatók a membránból, melyek csak a protein-protein
kapcsolatokat bontják meg. Ezzel szemben az integráns membránfehérjék ezzel a
módszerrel nem távolíthatók el.
Hogy egy membránfehérje miként köt a
membránhoz, azt a funkciója határozza meg:
1. A transzmembrán
proteinek mindkét oldalon funkció képesek és például molekulát tudnak
transzportálni a membránon keresztül.
2. Sejtfelszíni
receptorok is transzmembrán proteinek. Ha a külső oldalon köt valamilyen
molekula (ligand) hozzájuk, akkor egy intracelluláris szignált képeznek.
3. Az intracellulárisan képződött szignál továbbításában szerepet
játszó proteinek pedig a membrán belső felületéhez kötődnek, mint perifériális
fehérjék.
A legtöbb membránfehérje a-hélix-szel szeli át
a kettős réteget
|
|
A transzmembránfehérjéknek jellegzetes
orientációja van a membránban, mivel nem mindegy, hogy a molekula mely része
van a membrán bizonyos oldalán. Ez egyértelműen jelzi, hogy aszimmetrikusan
helyeződnek a lipid kettős rétegbe.
A membránból kilógó két részt a membránt
átszelő szegmens választja el, ami hidrofób aminosavakat tartalmaz, és elmerül
a membrán hidrofób belsejében. A fehérjékben lévő peptid-kötés azonban poláros
és mivel a lipid kettős rétegben nincs víz, ezért a peptid kötéseknek egymással
kell hidrogén-kötést kialakítaniuk. A hidrogén-kötések az a-hélix-ben
maximálisak. A transzmembrán fehérjék lipid kettősréteget átszelő szakasza,
ezért általában a-hélix. A membránt egyszer átszelő
transzmembrán fehérjék, ezért mindig tartalmaznak egy a-hélix
struktúrát.
A membránt többször átszelő transzmembrán
fehérjék a hidrogén-kötések maximális követelményének b-redővel is
eleget tehetnek. Ilyenek pl. a porin
fehérjék a Gram negatív baktériumok külső membránjában.
Ha egy fehérje bemerül a membránba,
akkor azt át is szeli, mivel a lánc meghajlása csökkenti a
hidrogén-kötéseket. Tehát a hidrogén-kötések maximalizálási elve magyarázhatja,
hogy nem ismerünk olyan fehérjét, ami csak részlegesen merül a membránba.
A transzmembrán fehérjéket nagyon nehéz
kristályosítani és ezért csak nagyon keveset lehetett röntgen
krisztallográfiával vizsgálni. A fehérjét kódoló gén klónozása és szekvenálása
azonban lehetőséget ad a fehérje elsődleges szerkezetének (aminosav sorrend)
megállapítására. Az aminosav sorrend alapján pedig megállapítható, hogy a
fehérje mely része hatol át a membránon, ha figyelembe vesszük, hogy:
1. a lipid kettős réteg
átszeléséhez kb. 20-30 aminosavra van szüksége, és
2. ezeknek alapvetően
hidrofób aminosavaknak kell lenniük, hogy a lipid kettős rétegbe
bemerülhessenek.
Membránfehérjék detergensekkel szolubilizálhatók és
tisztíthatók
|
|
A vízoldható globuláris fehérjék megtartják
natív konformációjukat és egyedi fehérjékként oldódnak vizes oldatban. Ezzel
szemben az integráns membránfehérjék
aggregálódnak és kicsapódnak, ha kikerülnek a membránból. Transzmembrán
fehérjék (és a membránhoz szorosan kötött fehérjék) csak hidrofób
kölcsönhatásokat megszüntethető szerekkel vihetők oldatba (szolubilizálhatók).
|
|
Ilyen szerek a detergensek, amelyek ugyancsak amfipatikus molekulák (hidrofób
csoportokhoz és vízhez is van affinitásuk). Vízben micellákat képeznek és ha sejtmembránnal lépnek kapcsolatba, akkor
a membránfehérje hidrofób részéhez kötnek és kiszorítják onnan a lipideket.
Mivel a molekula másik fele poláris, ezért a fehérjét oldatba hozzák, mint egy
detergens-protein komplex.
A detergens poláros feje lehet:
1. töltött (ionos): ilyen pl. az SDS (sodium dodecyl
sulfate), ami denaturálja a
fehérjéket, mert a belső hidrofób magjukhoz köt (ld. SDS gél
elektroforézis).
2. semleges (nem ionos): pl. Triton
X-100, ami kis koncentrációban nem denaturálja a membránfehérjéket, de
oldja azokat. Triton X-100-al aktiv formában izolálhatók a membránproteinek.
Eritrocita membrán
|
|
A legjobban ismert sejtmembrán az eritrocita
membrán, mert
1.
könnyű beszerezni
2.
nem szennyezett más sejtekkel,
3.
eritrocitának csak plazmamembránja van
(nincs organelluma), szemben más sejtekkel ahol a plazmamembrán az összmembrán
felületnek csak 5%-a).
Az eritrocita sejtmembránját emellett még
könnyű is preparálni, mert ha a sejteket kis sókoncentrációjú oldatba teszik,
akkor szétdurrannak, a hemoglobin kiszabadul és ún. "ghost"(szellem) képződik. A “ ghost” többféleképpen is
vizsgálható:
1. lukas
(leaky) formában,
2. hegesztett
(sealed) formában, aminek
n
normális fele van kívül (right side
out) vagy
|
|
n
a belső fele van kívül (inside out
vesicles).
Fagyasztva töréses elektronmikroszkópia használatos a membránok
vizsgálatára
|
|
Ennek lényege illetve alkalmazásának főbb
lépései a következők:
1. sejteket folyékony
nitrogénben fagyasztják,
2. a fagyott mintát
késsel törik úgy, hogy
3. a törés a hidrofób
rétegben következik be.
A törött felszínen kitüremkedések
(protuberanciák) figyelhetők meg, amik a membránfehérjéktől erednek. A
citoplazmás oldal neve P-felszin (protoplazmás), míg az exoplazmás oldalé
“E-felszín”.. A két felszín gyakran egymás tükörképe. A membránfehérjék mindig
az egyik felszínhez ragadnak, mégpedig ahhoz, amelyikhez sokkal jobban kötődnek.
|
|
Sok membránfehérje is diffundál a membrán síkjában
Csak1970-ben
bizonyították, hogy a plazmamembrán fehérjék többsége mobilis a membrán
síkjában.
|
|
Egér és humán fibroblaszt sejteket
fuzionáltatattak, melynek eredményeként egy heterokarion jött létre. Mindkét faj egy-egy membránfehérjéje ellen
ellenanyagot (antitest) állítottak elő, amikhez különböző színű fluoreszcens
festékeket kacsoltak. A sejtfúziós terméket 37oC-on különböző ideig
inkubálták, majd jégen hűtötték és glutáraldehiddel fixálták. A sejtfúziót követően
a két membránfehérje még külön régióban volt kimutatható, de az inkubálás során
folyamatosan elkeveredtek.
Folt- (patching) és sapka-képződés (capping) is a fehérjék
mozgására utal
Ha membránfehérje ellen termelt multivalens
(több kötőhellyel rendelkező) antitestet adnak a sejtekhez, akkor az adott
fehérjék aggregálnak (patching) az antitest által okozott keresztkötés miatt.
Ez is igazolja, hogy a fehérjék diffundálnak a membránban. Ha egyszer
aggregálódtak a fehérjék, akkor általában a sejt egyik pólusára vándorolnak
(capping).
Fluorescence recovery after photobleaching (FRAP)
A membránfehérjék diffúziójának kvantitativabb
mérése a fluorescence recovery after
photobleaching (FRAP) módszeren alapul.
A felületi fehérjére specifikus ellenanyagot
(antitest) itt is fluoreszcens festékkel kapcsolják. A foltképzés (patching)
elkerülése miatt fontos, hogy monovalens (egy kötőhelyes) legyen az antitest.
Lézerrel a festéket elszíntelenítik kis területen. A fehérített terület
fluoreszcenciája időben növekszik, mert bediffundálnak a nem elszíntelenített molekulák. A fluoreszcencia növekedéséből a
fehérje diffúziós koefficiense (D) meghatározható. Ennek értéke az egyes membránfehérjékre
nagyon különböző, de általában a proteinek D-je kb. 1/10-e vagy 1/100-a a
lipidekének.
|
|
A sejtmembránban fehérjék és lipidek specifikus régiókban
tömörülhetnek
A biológiai membrán két dimenziós folyadék, de
ez nem jelenti azt, hogy a fehérjék mindegyike úszik a lipid tengerben. A
sejtek gyakran korlátozzák a fehérjék membránban való úszását.
|
|
Epitéliális (hám) sejtek (pl. bél és vese)
számára pl. nagyon fontos, hogy a különböző sejtfelszínükön (apikális, bazális
és laterális felszín) különböző fehérjék helyezkedjenek el. Ez az
aszimmetrikus fehérje eloszlás, ami alapvető jelentőségű a hámsejtek funkciójához
az ún. tight junction-el valósul
meg.
|
|
Alapvetően négy oka lehet annak, hogy bizonyos
plazmamembrán fehérjék laterális diffúziója korlátozott:
1. A
fehérjék és lipidek szeparálódását legalábbis részben az intercelluláris barrierek (tight
junction) okozhatják.
2. A
fehérjék aggregálódhatnak (bakteriorodopszin a Halobacterium bibormembránjában)
Makromolekulával lépnek kapcsolatba a sejten
3. belül vagy
4. kívül.
A sejtfelszínt szénhidrát molekulák boritják
A
plazmamembrán fehérjéket szénhidrátok “dekorálják” és rejtik el minden
eukarióta sejt felszínén. A szénhidrát láncok proteinekhez (glikoproteinek) és
lipidekhez (glikolipidek) kötődnek kovalensen. A sejtburok (glycocalyx, cell coat) kifejezés a sejtfelszín
szénhidrátban gazdag régiójára utal. Festhető és lektinek kötnek hozzá.
A KcsA bakteriális káliumcsatorna vázlatos szerkezete
