Sejtkémia
(Készítette:Parrag Tamás vegyész hallgató)
Tartalom
-Sejtet alkotó anyagok
-Makromolekulák felépülése apróbb egységekből:
-Szacharidok:
-Monoszacharidok
-Oligoszacharidok
-Poliszacharidok
-
Zsírok/
lipidek/ membránok
- Nukleinsavak
- Aminosavak:
- Csoportosítás
- Aminosavak halmazszerkezete
-Fehérjék
-Kémiai kötések:
- Elsőrendű kémiai kötések
- Másodrendű kémiai kötések
Sejtet
alkotó anyagok:
A sejtben, egy időben több ezer biokémiai folyamat is lejátszódhat. Valamennyi élettani és fizikokémiai átalakulás a sejt molekuláris szintjén zajlik le. Ez a megállapítás érvényes az információs folyamatokra is. A sejteket felépítő legfontosabb elemek a C, N, O, P, S. Ezen atomok kombinációjával számos élő szervezetet felépítő fehérjék, lippidek, DNS, RNS, membránok építhetők fel. Az anyagok melyek még fontosak az élő szervezetben az ionok, az emberi vér az ionok közül leggyakrabban a Na+, K+, Ca2+ kationok illetve a Cl- és a HCO3- anionok fordulnak elő. És amit nem említettem meg a víz az ami mindent körülvesz (álltalábba legfontosabb közvetítő közeg) anyag, információ, áramlás, és kémiai reagens, szóval az élet alapja.
1.Ábra.Sejtet alkotó anyagok kémiai anyagok
2.Ábra.Sejtet alkotó
kémiai vegyületek
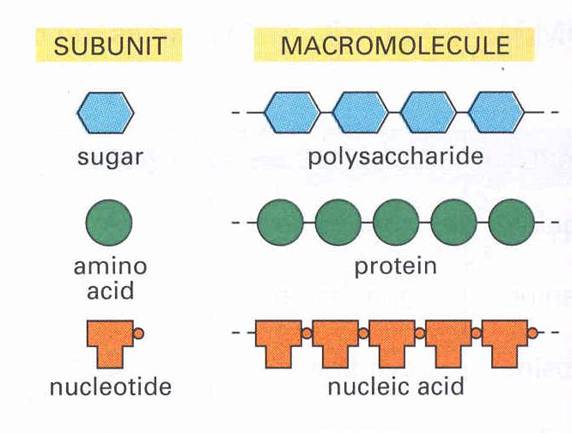
Makromolekulák felépülése apróbb egységekből:
Különböző kémiai/biokémiai reakciók során kicsi szerves molekulákból makromolekulák képződnek.
Cukrokàpoliszacharidok
Zsírsavakàzsírok/lipidek/memránok
Aminosavakàfehérjék
Nukleotidokànukleinsavak
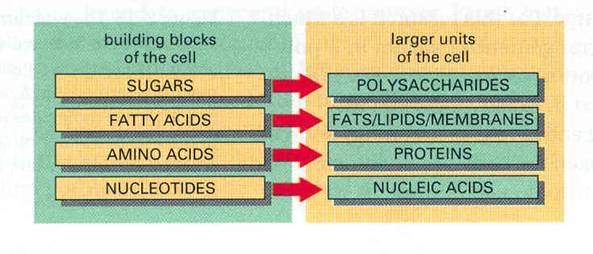
3. ábra
Makromolekulák keletkezése vegyületekből
4. ábra
Makromolekula lánc keletkezése vegyületekből
Monoszacharidok/cukrok:
A legegyszerűbb szénhidrátok, általában 3, 4, 5, 7, de leggyakrabban 6 szénatomot tartalmazó molekulák. Vízben jól oldódnak, édes ízűek (pl. szőlőcukor, gyümölcscukor). Ezek a hat szénatomos cukrok a C6H12O6 összegképlettel jellemezhetők. Ez az összegképlet a gyakorlatban 64 különböző vegyületet (izomereket; α, β, L, D) jelenthet, de a gyakoribb változatok száma kevesebb. (A fent említett glükóz és fruktóz mellett a mannóz és galaktóz is hexóz.)
Fontosságuk:
-a Oligoszacharidok, Poliszacharidok felépítésénél
-a
sejtek energiaforrásai
-nukleotidok,
nuleinsavak alkotórészei melyből a DNS és az RNS épül fel
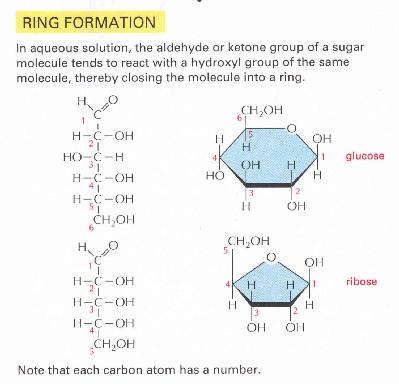
5. ábra Monoszacharidok lineáris és gyűrűs
szerkezete
Oligoszacharidok:
Az
oligoszacharidok olyan, glikozid típusú vegyületek, amelyekben az aglikonrész
is cukor. Úgy képződnek, hogy egy monoszacharid glikozidos hidroxilcsoportja
ugyanolyan vagy más monoszacharid valamelyik hidroxilcsoportjával vízkilépés
mellett reagál. Ez a kondenzációs folyamat tovább is folytatódhat, és ily módon
tri-, tetra-, penta- és hexaszacharidok képződhetnek. Ha az összekapcsolt
monomerek száma 7–10-nél nagyobb, akkor már poliszacharidokról van szó:

6. ábra
Monoszacharidokból Poliszacharidok Oligoszacharidok keletkezésének reakció egyenlete
Poliszacharidok
Ha az
összekapcsolt monomerek száma 7–10-nél nagyobb, akkor már poliszacharidokról
van szó:
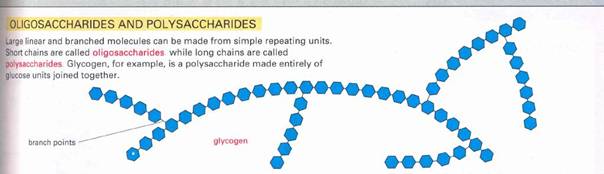
7. ábra
Oligoszacharid Poliszacharid molekula váza
Cellulóz
- β-D-glükóz egységekből épül
fel.
- Általános képlete: (C6H10O5)n.
- Az egységek 1-4'-b-glikozidkötéssel
kapcsolódnak össze (ls. cellobióz).
- Fonalszerű, lineáris molekula.
- A konformációt hidrogénkötések
stabilizálják egyrészt az egymás után következő glükózrészek között,
másrészt a láncok között (kötegekbe rendeződés).
- Fehér színű, íztelen, szilárd anyag.
- Vízben gyakorlatilag oldhatatlan.
- Nem redukáló! (A molekula egyetlen
glükózegysége elvileg képes redukálni, de ez elenyésző hatású a molekula
egészét tekintve.)
- Biológiai jelentősége: növényi vázanyag
(sejtfal).
- Felhasználás: papír- és textilipari
nyersanyag; filmek, lakkok, műszálak gyártása.
Keményítő
- α-D-glükózegységekből épül
fel.
- Általános képlete: (C6H10O5)n
- Amilóz és amilopektin egységekből épül
fel!
- Az amilózban a-1-4'-glikozidkötésekkel
kapcsolódnak a cukormolekulák; az amilopektin esetében az
a-1-4'-glikozidkötések mellett kb. 20-25 glükózegységenként elágazások
találhatók a-1-6'-glikozidkötésekkel!
- Az amilóz spirális lefutású (hélix), az
amilopektin helyenként spirális de az elágazódások miatt ágas-bogas
szerkezetű.
- A konformációt hidrogénkötések
stabilizálják egyrészt az egymás után következő glükózrészek között,
másrészt a spirál "emeletei" között.
- Fehér színű, íztelen, szilárd anyag.
- Hideg vízben nem oldódik, forró vízben
kolloid rendszert képez.
- Nem redukáló!
- Biológiai jelentőség: a növények
raktározott tápanyaga.
Glikogén
- Az amilopektinhez hasonló szerkezetű, de
nagyobb moláris tömegű vegyület, még gyakoribb elágazódásokkal!
- Biológiai jelentőség: állati
tartaléktápanyag (máj, izmok).
Kitin
- A cellulózhoz hasonló szerkezetű.
- Alapegységei N-acetil-glükózamin
molekulák.
- Biológiai jelentőség: Az ízeltlábúak és
egyes férgek kültakaróját képezi.
Heparin
- Glükózamin és glükuronsav (a 6. szénatomon
karboxilcsoport található!) alapegységekből épül fel.
- Vízoldékony.
- Biológiai jelentőség: alvadásgátló.
Zsírok/ lipidek/ membránok:
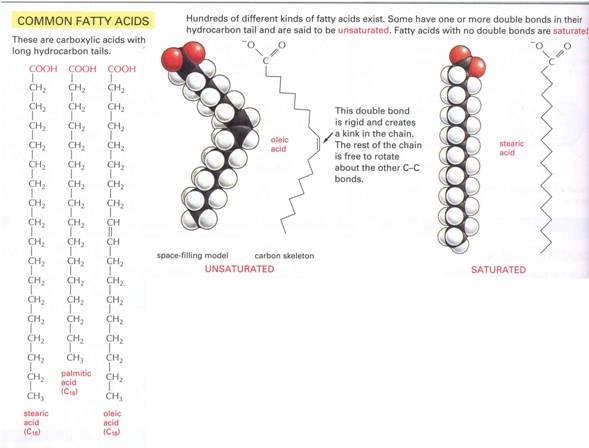
8.
ábra Zsír, olaj, zsírsav és olaj sav molekulla váza
Lipidek
- vízoldhatatlan, de szerves oldószerekben oldódó biomolekulák összefoglaló neve
- lipidek csoportjai:
- zsírsavak - hosszú szénláncú karbonsavak (C12 - C20)
- zsírok és olajok -
zsírsavak és glicerin triészterei (trigliceridek)
(a monogliceridek monoészterek, a digliceridek diészterek)
(energiatároló funkció)
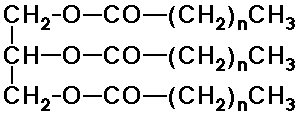
- foszfatidok - a
glicerin foszfátészterei (+ zsírsavak)
(membrán-összetevők)
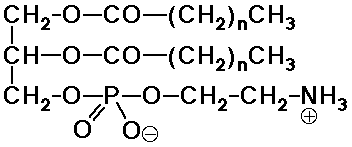
Zsírok és olajok
- a zsírok szilárdak, az olajok folyékonyak (azonos triglicerid-szerkezet)
- oldhatatlan lerakódás, melyből szükség esetén energia nyerhető
Zsírsavak
- az összes természetes zsírsav páros számú szénatommal rendelkezik, mivel acetátegységekből (C2) szintetizálódnak
- a természetes telítetlen
zsírsavakban cisz-konfigurációjú kettős kötések találhatók
a cisz kettős kötések alacsonyabb olvadáspontot eredményeznek
a telítetlen és a többszörösen telítetlen zsírok könnyebben emészthetők.
Foszfolipidek
- a szappanszerkezet
természetes megfelelője
poláris foszfátfej
két apoláros farok
A membránlipidek túlnyomó többsége foszfolipid. Ha egy glicerinmolekulát 2 molekula zsírsavval
és egy molekulát foszfát csoporttal észteresítünk, akkor pedig foszfolipidhez
jutunk.
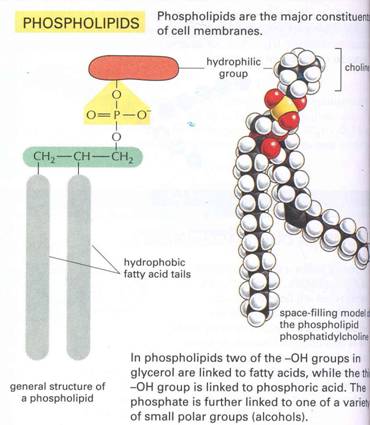
9. ábra foszfolipid általános sémája
Kétrétegű lipid membránok
- foszfolipidekből felépülő kétrétegű membrán ,más lipidek a membrán apoláris részében találhatók.
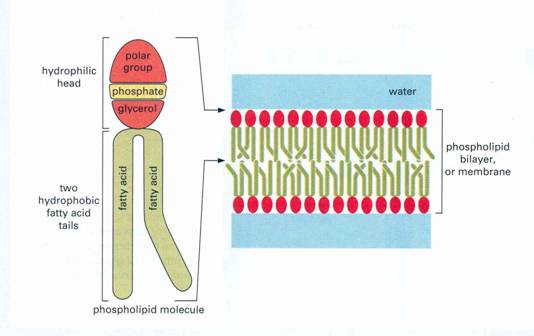
10. ábra
Foszfolipid mebránban felvett alakja
A membrán:
A sejtmembrán alapja egy lipidmolekulából álló kettős
réteg. A lipidmolekulák legjellemzőbb s a membránalkotás szempontjából igen
fontos tulajdonsága, hogy egyik végük vízben oldódó, hidrofil, a másik végük
zsírszerű, vízben nem oldódó, hidrofób. A membránlipidek túlnyomó többsége
foszfolipid. Ha egy glicerinmolekulát 2
molekula zsírsavval és egy molekulát foszfát csoporttal észteresítünk, akkor
pedig foszfolipidhez jutunk.
Vizes közegbe kerülve a foszfolipidmolekulák spontán kettős réteggé rendeződnek, olyanformán, hogy a külső oldalon a víz felé néznek a hidrofil fejek, és befelé, a kettős réteg belseje felé a hidrofób farkok, amelyek kiszorítják onnan a vizet. A kialakuló membránok a vízben gömb alakot vesznek fel(micellák), vezikulákat alkotnak. A foszfolipid kettős réteg ellátja a hártya elválasztó funkcióját, az elhatárolás feladatát. A közlekedést a membránon keresztül s a többi funkciót a lipidrétegbe ágyazódott fehérjemolekulák biztosítják. Ezek adják meg a különböző membránoknak a sajátos megkülönböztető jegyeket, s hajtják végre speciális feladatait. Mintegy szivattyúként működnek, s a sejt szükségleteinek megfelelően, a kívülről és belülről kapott információk alapján, nyitják és zárják a csatornákat, és biztosítják az anyagok ki és bevándorlását.
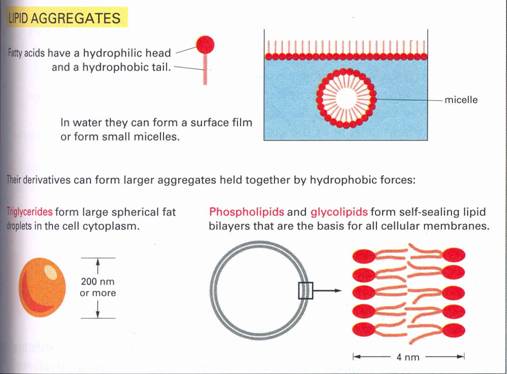
11. Ábra. Zsírsavak foszfolipidek és glikolipidek rendeződése vizes
oldatban.
Ennek a jelenségnek energetikai oka van: ez az elrendezés biztosítja a legalacsonyabb szabad energia szintet. A membránokat biológiai szempontból két tulajdonságuk teszi nagyon fontossá: mivel belsejük hidrofób szénhidrogén, átjárhatatlanok a biológiai molekulák aminosavak, nukleinsavak, fehérjék, cukrok és ionok számára. Ezért működhetnek válaszfalként. A másik nagyon fontos tulajdonságuk, hogy lágyak, rugalmasak, viszkozitásuk az olajéhoz hasonló. Tulajdonképpen kétdimenziós folyadékok.
Nukleinsavak:
Az élő szervezet minden biológiai tulajdonságának
átörökítéséért felelős makromolekulák!
Savval főzve hidrolizálnak, és a hidrolizátum:
foszforsavat,
ötszénatomos cukrot,
és nitrogéntartalmú
heterociklusos vegyületet tartalmaz.
Építőegységeik a NUKLEOTIDOK!
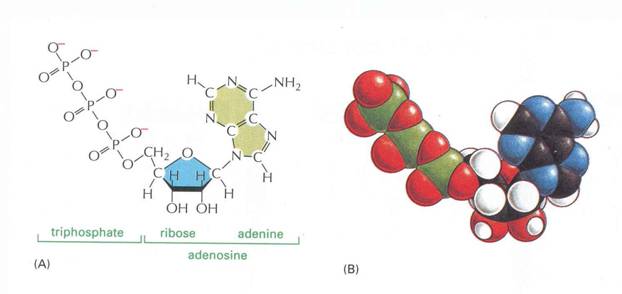
12. ábra
Nukleotidok
A nukleotidok felépítése:
PENTÓZ: D-ribóz (RNS) vagy 2-dezoxi-D-ribóz (DNS).
A pentóz 1'-szénatomjához kapcsolódó nitrogéntartalmú heteroaromás
bázis:
- PURINVÁZAS bázisok: adenin, guanin
- PIRIMIDINVÁZAS bázisok: citozin, uracil, timin
A pentóz 5'-szénatomján lévő hidroxilcsoportját
észteresítve foszforsav.
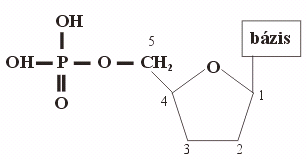
A nukleotidok szerepe
Tri- és difoszfátjai a szervezet energiahordozói: ATP,
ADP!
Koenzimek alkotórészei: NAD, NADP, KoA!
A sejtek kommunikációs kapcsolataiban játszanak szerepet: cAMP!
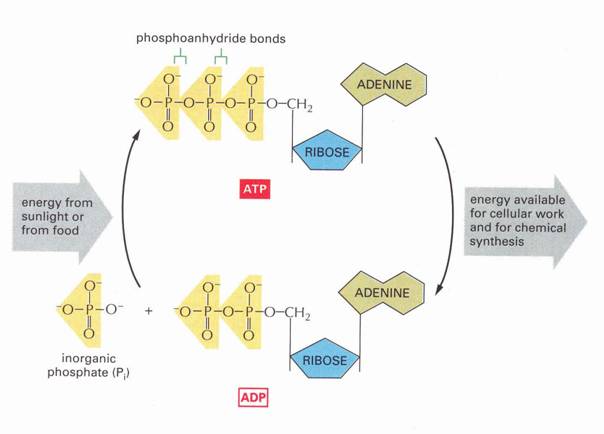
13. ábra
Energia körfolyamat
A nukleinsavak alkotórészei!
A nukleinsavak felépülése
A nukleinsavak nukleotidokból épülnek fel. A
polinukleotidlánc tulajdonképpen poliészterlánc, melyben a nukleotid pentózának
5' szénatomjával észterkötésben lévő foszfátcsoport a másik nukleotid
pentózának 3' szénatomján lévő hidroxilcsoporttal kondenzációs reakcióban
(vízkilépés) hoz létre észterkötést.
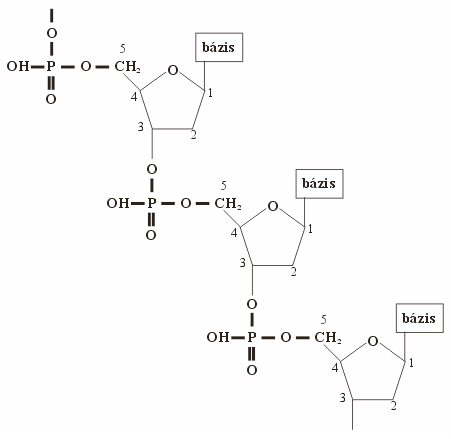
A nukleisavak fajlagossága
A cukor-foszfát-lánc egységei monoton ismétlődnek, ezek
tehát nem specifikusak! A molekula egyediségét a nukleotidok bázisai, azok szekvenciája
(sorrendje) szabja meg!
A nukleinsavak konformációja
A cukor-foszfát-lánc különböző pontjai között
hidrogénkötések jöhetnek létre. Egy-egy lánc különböző szakaszai - RNS esetén
-, kettős polinukleotidláncnál - DNS esetén - a két lánc bázisai között jöhetnek
létre hidrogénkötések, de csak meghatározott formában! Az adenin két
hidrogénkötéssel csak timinhez (DNS) illetve uracilhoz (RNS), míg a guanin
három hidrogénkötéssel csak citozinhoz kapcsolódhat!
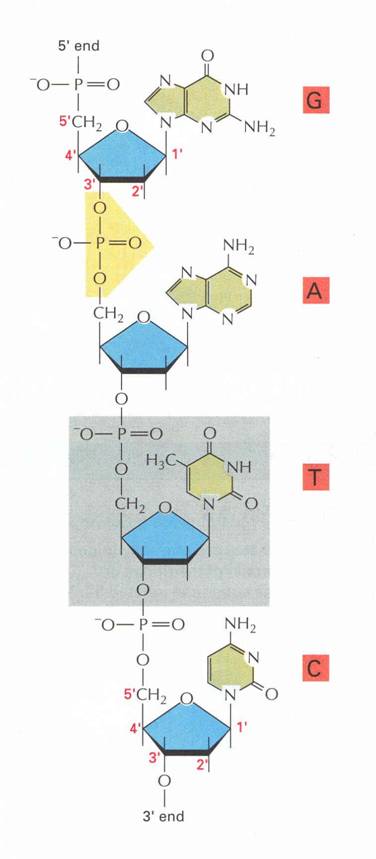
14. ábra DNS
felépítése
Aminosavak:
Fehérjékből savas hidrolízis hatására aminokarbonsavak,
röviden aminosavak keletkeznek.
Az aminosavak olyan vegyületek, amelyek molekulájában aminocsoport és karboxilcsoport
egyaránt előfordul. Biológiai jelentőségüknél fogva ehelyett
csak a fehérjeeredetű aminosavakkal foglalkozunk.
A fehérjék építőkövei az a-aminosavak!
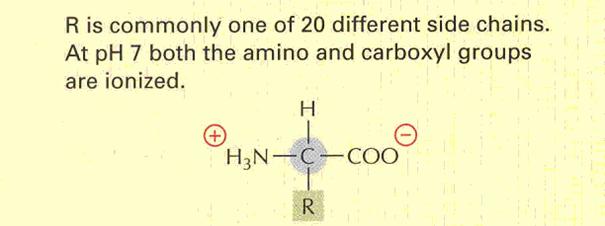
Általános szerkezetük:
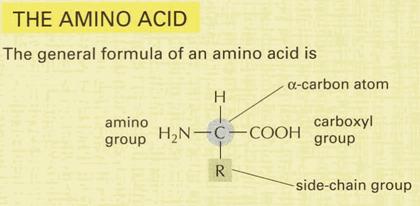
15. ábra
Aminosavak általános felépítése
Az aminocsoport a 2., azaz az
α szénatomon helyezkedik el. Az α
szénatom királis, kivéve, ha R=H! A természetes aminosavak L-konfigurációjúak,
azaz konfigurációjuk analóg az L-glicerinaldehid konfigurációjával.
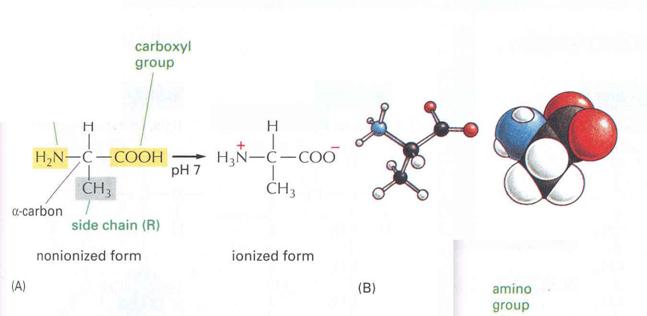
16. ábra
a) Amino csoport elhelyezkedése b) Aminosav ikerionos formája
A természetes aminosavak közül mintegy 20,
különböző alkilcsoportot (R-csoport) tartalmazó molekula a legelterjedtebb.
Csoportosítás
Az oldallánc jellege szerint történhet.
- APOLÁROS
- POLÁROS
|
o
Vízmolekulákkal
hidrogénkötést tud létesíteni. o
Vizes oldatban az oldalláncban lévő karboxilcsoport disszociált
formában vagy anion alakban, az erősen bázisos csoport pedig protonált
formában vagy kation alakban van jelen. |
Eszerint a természetes aminosavak
"R"-lánca:
- Semleges, apoláros
Példa:
|
R = H |
amino-ecetsav: H2N-CH2-COOH
GLICIN |
|
R = CH3 |
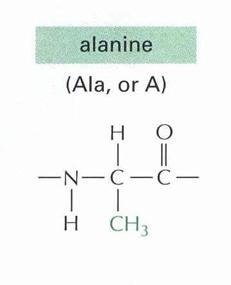
2-amino-propánsav vagy ALANIN |
|
R = CH2-C6H5 |
FENILALANIN |
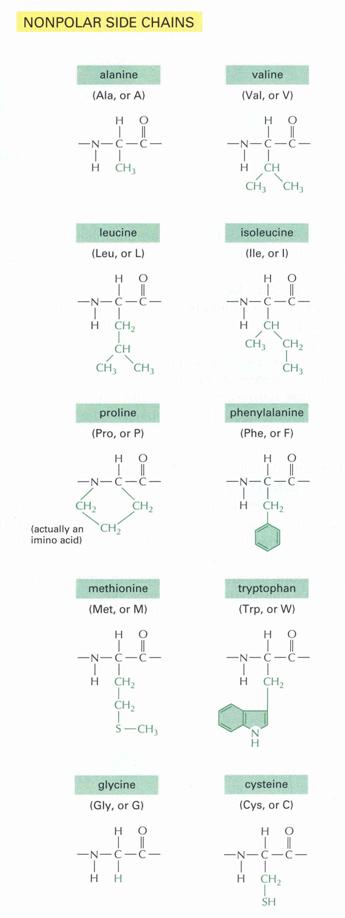
- Semleges, poláros
Példa:
|
R = CH2-OH |
SZERIN |
|
R = CH2-SH |
CISZTEIN |
|
R = CH2-CO-NH2
|
ASZPARAGIN |
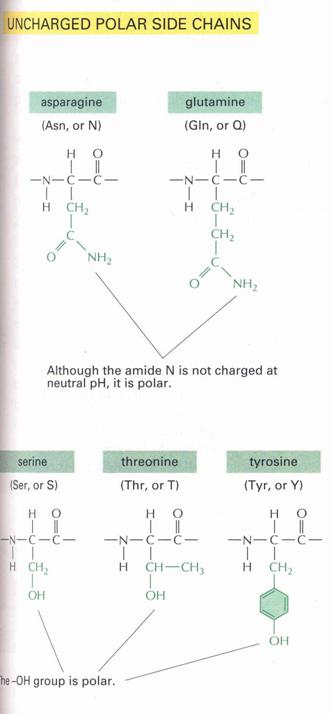
- Poláros, gyengén savas
Példa:
|
R = CH2-C6H4-OH
|
TIROZIN |
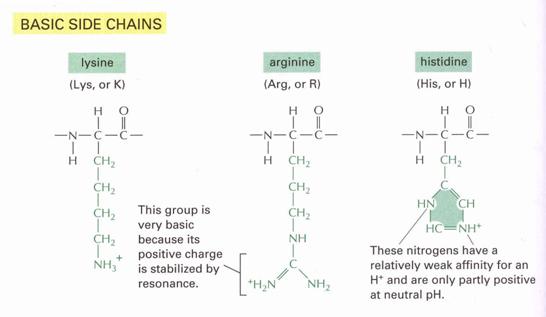
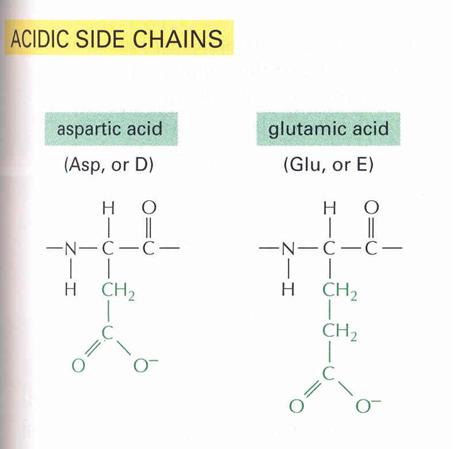
- Poláros, erősen savas vagy bázikus
Amino-dikarbonsavak és diamino-karbonsavak tartoznak ide:
Bázikus aminosav:
Savas aminosav:
Példa:
|
R = CH2-COOH |
ASZPARAGINSAV |
|
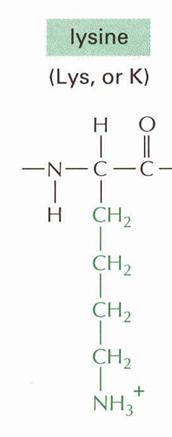
R = (CH2)4-NH2 |
LIZIN |
Más megfontolás alapján a fehérjéket felépítő
aminosavak feloszthatók három nagy csoportra, de még ezeken
a csoportokon belül is kisebb alcsoportok különböztethetők meg.
1.)
MONOAMINO-MONOKARBONSAVAK
Egyetlen bázisos aminocsoportot és egyetlen
savas karboxilcsoportot tartalmaznak. Neutrális aminosavaknak is tekinthetők,
mert bennük azonos a savas és bázisos csoportok száma.
- Apoláros oldalláncú aminosavak
Ebbe az alcsoportba olyan aminosavak tartoznak, amelyek oldalláncként alkilcsoportot tartalmaznak. Ide sorolhatók: glicin (Gly) [az oldallánc helyén hidrogénatomot tartalmaz, az egyetlen akirális aminosav!], alanin (Ala), valin (Val), leucin (Leu), izoleucin (Ile). - Alkoholos oldalláncot tartalmazó aminosavak
Ide két aminosav sorolható: szerin (Ser), treonin (Thr).
- Kéntartalmú aminosavak
Ide szintén két aminosav tartozik: cisztein (Cys), metionin (Met).
- Aromás oldalláncot tartalmazó aminosavak
Ide három aminosavat sorolhatunk: fenilalanin (Phe), tirozin (Tyr), triptofán (Trp).
- Prolin (Pro), amely
gyűrűvé záródik, és a szekunder aminokra jellemző iminocsoportot
tartalmaz.
- Aszparagin (Asn),
glutamin (Gln), amelyek amidok.
2.
MONOAMINO-DIKARBONSAVAK
Egy bázisos aminocsoport és két savas
karboxilcsoport fordul elő! Ezeket savas aminosavaknak nevezzük. Ide tartozik az aszparaginsav (Asp) [a második
karboxilcsoport a béta szénatomhoz kapcsolódik] és a glutaminsav (Glu)
[a második karboxilcsoport a gamma szénatomhoz kapcsolódik].
3. BÁZISOS
AMINOSAVAK
Jellemző ezen
molekulákra, hogy egy második bázikus csoportot is tartalmaznak, ilyen a lizin
(Lys), ahol a második bázikus csoport aminocsoport; a hisztidin (His),
itt gyengén bázisos 4-imidazolilcsoport található; valamint az arginin
(Arg), melyben igen erős bázisos sajátságú guanidino-csoport található.
Az aminosavak
halmazszerkezete
Minden aminosav tartalmaz legalább egy
bázikus amino- és egy savas jellegű karboxilcsoportot. Vizes oldatban, de
kristályosítva, szilárd állapotban is az aminocsoport protonált, a
karboxilcsoport protonálatlan állapotban van: ikerionos szerkezetű!
17. ábra
Aminosav ikerionos szerkezete
Az aminosavak ezért standardállapotban
szilárd halmazállapotúak, a rács ionos jellegű.
Tulajdonságaik
- Amfoterek,
tehát a vízben rosszul oldódó (nagy, apoláros jellegű láncot tartalmazó)
típusaik is feloldhatók sav-, illetve lúgoldatban (savoldatban a
karboxilátion protonálódik, lúgoldatban az alkil-ammóniumion ad le egy
protont).
- A vízoldékony aminosavak vizes oldatának kémhatása a karboxil- és
az aminocsoportok, valamint az egyes csoportok sav-bázis erősségétől (Ks,
Kb) függ. Az amino-dikarbonsavak savas, a diamino-karbonsavak
lúgos kémhatást okoznak a vízben, de az egyetlen amino- és egyetlen
karboxilcsoportot hordozó aminosavak sem feltétlenül semlegesek. Példa
erre, hogy a glicin vizes oldata gyengén savas kémhatású, mivel a Ks=
4,5·10-3, a Kb= 2,5·10-10.
- A természetes eredetű aminosavak a fehérjékben amidkötéssel, biológiai értelemben peptidkötéssel kapcsolódnak.
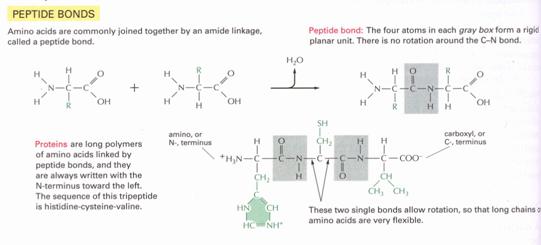
18. ábra
peptidkötés kialakulása különböző aminosavak között
Fehérjék
Alapszerkezet
Egy vagy több, aminosavakból összekapcsolódó
polipeptidláncból és esetenként szervetlen vagy szerves, nem polipeptid típusú
részből álló makromolekulák.
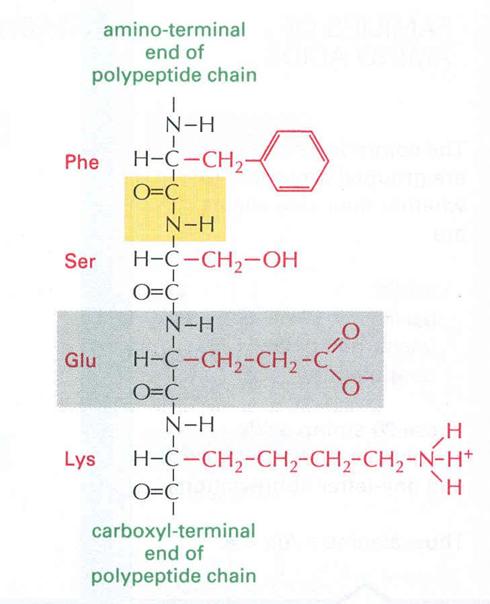
19. ábra
Polipeptidlánc
Jellemzők
Specifikus makromolekulák, melyben az építőegységek
(aminosavak) sorrendje egyediséget kölcsönöz az adott molekulának!
Szerkezet
a.) Elsődleges szerkezet (primer struktúra)
- aminosavszekvencia
(aminosavsorrend)
- az egyediséget a polipeptidláncban oldalláncként jelentkező
R-csoportok sorrendje biztosítja.
- A polipeptidlánc a peptidkötés körül nem foroghat (az oxocsoport
pi-kötése és a nitrogén atom nemkötő elektronpárja delokalizálódik, ezzel
rögzül a peptidkötés! /ls. ábra/).
- A merev, síkalkatú peptidkötések közötti (az alfa-szénatom körül!)
részlet mindkét oldalon elfordulhat (az ún. amidsíkok az alfa
szénatom körül elforoghatnak). Az elvileg végtelen lehetőség közül az
R-oldalláncok nagysága és töltése miatt jó néhány nem valósulhat meg.
- Mégis a természetben egy adott fehérje csak egy vagy néhány konformációban
fordul elő. Ennek oka a környezet (pH, ionkoncentráció, hőmérséklet stb.)
viszonylagos állandóságában keresendő.
A fehérjék természetes lánckonformációja
b.) Másodlagos szerkezet (szekunder
struktúra)
- A lánckonformáció viszonylag monoton ismétlődő egységekből
kialakuló szerkezete, mely leggyakrabban az α-hélix, illetve a
β-redő.
- A lánckonformációt a peptidkötések atomjai között kialakuló
másodrendű kötések (pl. hidrogénkötések) tartják fenn, melyek a spirális
szerkezetben az egymás feletti struktúrákat (α-hélix), a
β-redőben az egymás mellé, hullámpapírszerűen rendeződött
láncrészeket tartják össze.
c.) Harmadlagos szerkezet (tercier struktúra)
- A másodlagos szerkezeti elemek - az α-hélix, β-redő -
egymáshoz viszonyított elrendeződését jelenti, beleértve az azokat
egymástól esetleg elválasztó rendezetlen, ún. random szerkezeti részeket
is!
- A lánckonformációt a másodrendű kötések mellett az oldalláncok
közötti ionos kötések (pl. a karboxilátion és az alkil-ammóniumion
között), illetve kovalenskötések (diszulfidhíd két cisztein
molekula között) tartják fenn.
d.) Negyedleges szerkezet (kvaterner
struktúra)
- A több polipeptidláncból álló fehérjemolekulákra jellemző, és a
polipeptidláncok egymáshoz való viszonyát jelenti.
- A különböző alegységek (polipeptidláncok) közötti kapcsolatot a tercier struktúrát fenntartó erőkhöz
hasonló kötések biztosítják.
A fehérjék
típusai
1.) Konformáció szerint
- FIBRILLÁLIS FEHÉRJÉK,
melyeknek tercier struktúrájára az jellemző, hogy
a molekuláknak csaknem teljes hosszában egyféle szekunder szerkezeti elem
van jelen, így a hajat α-hélix, míg a selymet b-redő szerkezeti
elemek építik fel.
- GLOBULÁRIS FEHÉRJÉK,
amelyek harmadlagos szerkezetére random (rendezetlen) szakaszok is
jellemzők, míg más szakaszok β-redőzött vagy α-hélix struktúrát
vesznek fel. Ilyenek az immunglobulinok, a hemoglobin, az albuminok.
Molekuláik nagyjából gömb alakúak.
2.) Vegyi összetételük
szerint
- Egyszerű fehérjék (proteinek), amelyek csak aminosavakra
hidrolizálhatók.
- Összetett fehérjék (proteidek), amelyek aminosavakon kívül más,
szerves vagy szervetlen, ún. nem fehérjerészt is tartalmaznak. Ilyen a
hemoglobinban a hem, ami vastartalmú porfirinvázas vegyület; a tejben a
kazein, ami foszfátcsoportot tartalmaz. A név utal a nem fehérje rész
milyenségére: lipoproteid (a nem fehérje rész lipid), glükoproteid (a nem
fehérje rész szénhidrát) stb.
3.) Funkció szerint
- Struktúrfehérjék, az élőlények szerkezetét meghatározó fehérjék
(szaru).
- Enzimek, vagyis biokatalizátorok.
- A sejtek kommunikációjában fontos fehérjék (hormonok,
receptormolekulák).
- Transzportmolekulák.
- A mozgásban jelentős fehérjék (aktin, miozin, mikrotubulosok
fehérjéi).
- Immunfehérjék (immunglobulinok).
- (Energiahordozók)
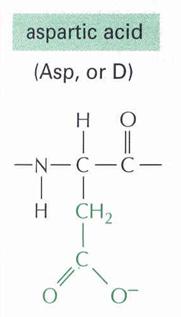
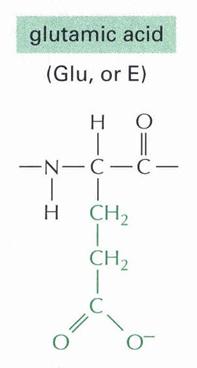
- Kálcium és nátrium szelektív memrán fehérjét felépítő aminosavak:
Nem megfelelő körülmények között a
természetes lánckonformáció megszűnhet, ennek okai:
- az ionkoncentráció megváltozása
- pH-változás (a töltéssel rendelkező csoportok töltése megszűnhet,
az oldalláncok ennek következtében elmozdulhatnak egymástól, és más oldalláncok
között jöhetnek létre kötések)
- hőmérsékletváltozás (a hőmozgás hatására előbb a gyengébb, majd
magasabb hőmérsékleten akár a kovalens diszulfidhidak is felszakadhatnak)
- sugárzások, amelyek képesek a kovalenskötések felszakítására.
Következményei:
- Denaturálódás: az eredeti funkció megszűnése.
- Koaguláció: a kolloid állapot megszűnése (kicsapódás).
Mind a denaturáció mind a koaguláció lehet megfordítható - reverzibilis -, vagy visszafordíthatatlan - irreverzibilis -.
Kémiai
kötések
Elsőrendű kémiai kötések:
a)
Ionos kötés: Olyan elsőrendű kémiai kötés, mely
ellentétes töltésű ionok között jön létre. Kationok: pozitív töltésű fémek,
Anionok: negatív töltésűek nemfémek. Az ion töltésszáma megmutatja, hogy az ion
töltése hányszorosa az elemi töltés értékének. 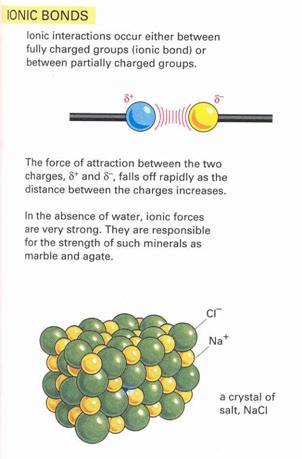
20. ábra
Ionos kötés kialakulása
b)
Szilárd állapotban az ionok ionrácsba
rendeződnek.
Rácsenergia: azaz energia, amely 1 mól kristályos anyag gázhalmazállapotú ionok
képződésekor szabadul fel.
Rácsállandó: az ionrácsban az ionok olyan távolságban helyezkednek el
egymástól, melyben közöttük fellépő vonzóerő és taszítóerő egyensúlyt tart.
b) Kovalens kötés: olyan elsőrendű kémiai kötés, mely közös
elektronpáron kialakuló kapcsolat. Általában nemfémes elemek között jön létre.
Ha azonos atomok között jön létre a kovalens kötés, ill. En= 0 akkor apoláris
kovalens kötés.
Ha különböző atomok között jön létre a kovalens kötés ill. En= 0<x<2 akkor poláris kovalens kötés. Lehet 1X, 2X, 3X
kovalens kötés attól függ, hogy hány elektronpár vesz részt a kötés
kialakításában.
Kötéstávolság: a két atommag közötti távolságot jelenti a molekulában. Jele: d
[pm]
Kötési energia: az az energia, amely egy mól molekulában az adott kötés
létrejöttekor szabadul fel. Jele: Ek KJ/mol
Molekulapálya: molekulának az a térrésze, ahol a kötő elektronpárok a
légvalószínűséggel megtalálhatók.
Kovalens vegyérték: egy atom annyi vegyértékű ahány kötő e- pár kapcsolódik
hozzá a molekulában.
Kötésszög: az atommagokat összekötő egyenesek által bezárt szög.
Molekula térbeli felépítése:
Kötéstávolság, kötésszög-túl függ.
Központi atom: azt a nagyobb vegyértékű elektront, amelyhez a többi kisebb
vegyértékű atom kapcsolódik. Atomcsoport is körülveheti
Ligandum: a központi atomot körülvevő részecskéket
közös néven nevezik.
Koordinációs szám: a központi atomot körülvevő ligandumok száma.
Delokalizált kötés: a kötő elektronpár 2-nél több atommag vonzása alatt áll, Pi
kötés van közötte.
Lokalizált kötés: a kötő elektronpár 2 atomtörzs vonzása alatt áll. Szigma és
Pi kötés van.
Datív kötés: olyan kovalens kötés, amelyben a kötő elektronpár mindkét
elektronját ugyanaz.
Molekula polaritása:
A molekulák
egy részénél a pozitív és negatív töltések középpontja nem esik egybe.
Dipólusmolekula: a két pólussal rendelkező molekula. 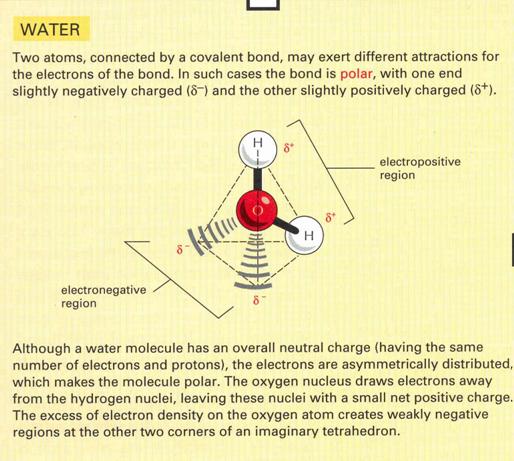
21. ábra
Víz váz szerkezete
Függ: a benne szereplő kötések polaritásától, a molekula térbeli
felépítésétől
A kötés polaritására az elektronegativitás jellemző a
molekula térbeli felépítésére a kötésszög.
Apoláris molekula: ha a molekulán belül a töltéseloszlás egyenletes
Poláris molekula: ha a molekulán belül a töltéseloszlás nem egyenletes
c) Fémes kötés: olyan elsőrendű kémiai kötés, mely az atomtörzs és a
delokalizált vegyértékelektronok közötti vonzás. A fémben a részecskék között a
kapcsolatot ez a nem lokalizált elektronrendszer teremti meg. Szilárd
állapotban fémrácsot alkotnak. En= 0
Másodrendű kémiai kötések:
a) Dipólus-dipólus:
ha a molekula dipólus, Keeson féle erők tartják, poláris molekulák között jön
létre. Pl. szilárd HCl, folyékony CH3Cl
b) Diszperziós: apoláris molekulák között, elektronfelhő eltorzulása
következtében jön létre, így a molekula rövid időre polárissá válik és így a
szomszédos molekula elektronfelhőjét is eltorzítja. H2,
02 CH4
c) Hidrogén-híd:
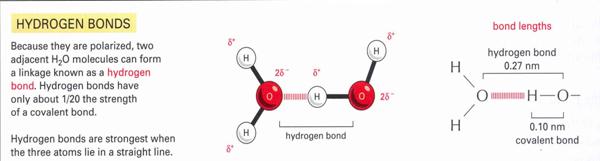
22.
ábraVízben lévő Hidrogén-híd
A hidrogén-híd vízmolekulák között jön létre:
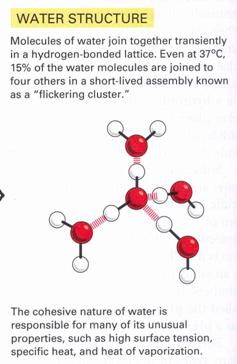
23. ábra
Viz szerkezete
Van der Walls kötés:
Dipól-dipól kötéshez hasonló elektrosztatikus vonzó erő.
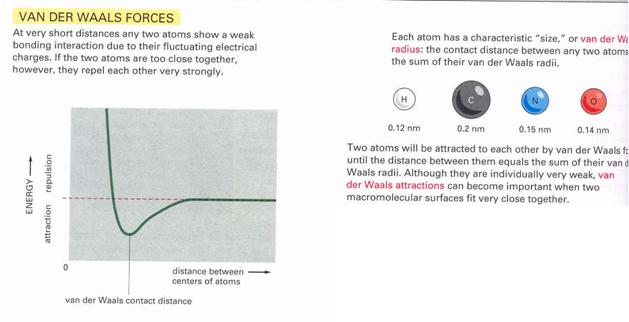
24.
ábraVan der Walls kötés energia állapotai
Hidrofil kölcsönhatás:
Olyan molekula, vagy nagyobb molekula része, amely képes a vízzel vonzó
kölcsönhatást kialakítani, és ezáltal a víz eredeti
hidrogén hidas szerkezetét felbontani és átszervezni.
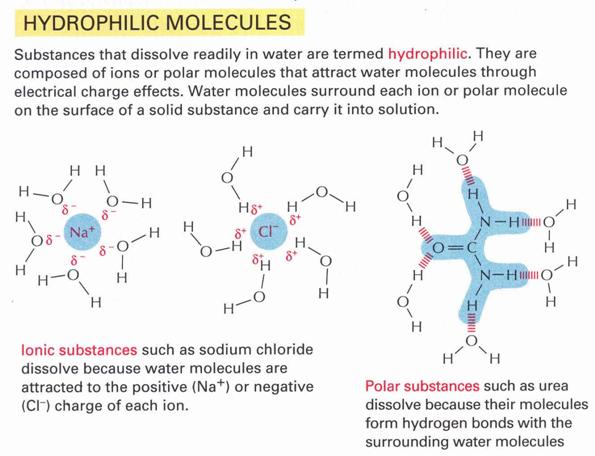
25. ábra
Hidrofil kölcsönhatás kialakulása
Hidrofób
kölcsönhatás:
Olyan molekula, vagy nagyobb molekula része, amely nem képes kialakítani a
vízzel jelentősebb vonzó kölcsönhatást. Ezeket a
csoportokat sajátos, rendezett hidrátburok (klatrát) veszi körül.
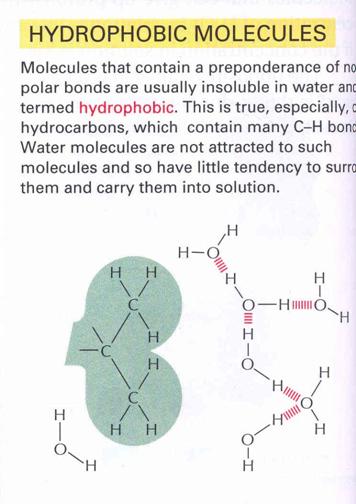
26. ábra Hidrofób
kölcsönhatás kialakulása
Hivatkozások, felhasznált irodalom:
- Szeberényi József Molekuláris sejtbiológia
- Lubert Stryer Biochemistry
- http://www.sulinet.hu/tovabbtan/felveteli/2001/20het/kemia/kemia20.html
- http://www.kfki.hu/chemonet/hun/eloado/szerves2/16notes.htm
- http://www.hik.hu/tankonyvtar/site/books/b55/ch03s04s02.html