Bevezető
Az ioncsatornák az ionoknak a sejtmembránon keresztül való transzportját szelektív módon megvalósító fehérjék. Ezen közlemény célja, hogy egy statisztikus termodinamikai leírásmód és Monte Carlo szimulációk, mint metodika segítségével megvizsgálja, hogy az ioncsatornák szerkezete milyen módon határozza meg azok ionszelektivitását. Egy rövid, az ioncsatornák élettani jelentőségét és szerkezetét bemutató áttekintés után közöljük a kalcium- és nátriumcsatornák szelektivitására vonatkozó eredményeinket.
Molekuláris biológiai háttér
A sejtet határoló lipid
kettősréteg, azon túl, hogy definiálja a sejt határait, védi azt a
külső behatásoktól és mechanikai
stabilitást biztosít neki. A
középen elhelyezkedő hidrofób réteg révén az ionokra és nagyobb poláros
molekulákra ez a lipidréteg nem áteresztő. Ahhoz, hogy élő sejtről
beszélhessünk, szükség van a sejt és környezete kölcsönhatására:
információcserére, anyagtransz-portra. Az olyan részecskék
transzportjára,
amelyeket a lipidréteg nem ereszt át, a természet ún. membránfehérjéket
alkotott. Ezek a lipidrétegen keresztültüremkedő óriásmolekulák
felelősek sok
más funkció mellett a különböző fiziológiailag fontos szervetlen ionok
(Na+,
K+, Ca++, Cl-) sejtmembránon keresztül
való
transzportjáért.
Szigorúan véve a
sejtmembránt a lipidréteg és a membránfehérjék együtteseként
definiálják. A
sejtmembrán tömegének mintegy 50%-át a membránfehérjék teszik ki. A
részecskék
továbbítására szolgáló fehérjéket több szempont szerint lehet
csoportosítani.
Aszerint, hogy az illető komponens továbbítása annak elektrokémiai
gradiense
mentén, vagy azzal szemben történik, passzív vagy aktív transzportról
beszélünk. Aktív transzport során kémiai vagy fényenergia, illetve egy
másik
komponens passzív transzportjának felhasználásával (csatolt transzport)
történik a továbbítás.
Passzív transzport esetén,
és ide tartoznak az ioncsatornák is, a membrán két oldala közt az adott
komponensre vonatkozó koncentrációgradiens, illetve a
potenciálkülönbség (ionok
esetében) együttes hatására mozognak a részecskék. Ezt a jelenséget
szokás
elektrodiffúziónak nevezni és a Nernst-Planck egyenlet írja le. A
sejten belül
(citoplazma) és kívül a különböző ionoknak eltérő a koncentrációja (ld.
1.
Táblázat). Ezeket a koncentrációgradienseket az aktív pumpák (mint pl.
a Na+-K+
pumpa) tartják fenn. Látható, hogy pl. a kálium-ionoknak a sejten belül
sokkal
nagyobb a koncentrációja, mint azon kívül. Ehhez a
koncentráció-arányhoz a
Nernst-egyenlet szerint egy kb. –100 mV-os potenciálkülönbség tartozik.
Mivel
egy tipikus állati sejtben, nyugalmi állapotban a sejtmembrán, az ún.
szivárogtató káliumcsatornák révén a káliumionokra nézve permeábilis,
az
egyensúlyi membránpotenciált ezek határozzák meg.
1. táblázat
A különböző, fontosabb ionok koncentrációja a sejten belül és kívül egy tipikus állati sejtben.
|
Koncentráció (mM) |
Belül |
Kívül |
|
Kationok |
|
|
|
Na+ |
5-15 |
145 |
|
K+ |
140 |
5 |
|
Ca++ |
10-7 |
1-2 |
|
Anionok |
|
|
|
Cl- |
5-15 |
110 |
|
Szerves molekulák |
Magas |
0 |
Az ioncsatornáknak két nagyon
fontos tulajdonságát kell megemlítenünk. Az egyik, hogy erősen
szelektívek,
azaz csak egyfajta ionra nézve áteresztőek, míg a többi ionra nézve
inkább nem.
Ez természetesen egy valószínűségi kijelentés, ami azt mondja, hogy a
csatorna
azt az iont, amelyre szelektív, nagyobb valószínűséggel engedi át, mint
a
többit. Jelen közlemény ennek a jelenségnek a vizsgálatával
foglalkozik.
Jelesül, arra a kérdésre szeretnénk választ kapni, hogy hogyan
következik a
fehérje struktúrális tulajdonságaiból a csatorna szelektivitása.
Szelektivitásról
természetesen csak nyitott csatorna esetében van értelme beszélni, és
ez az ioncsatornák
másik alapvető jellemzője: nyitott vagy zárt állapotban lehetnek,
mégpedig
szabályozott módon (gating). A nyitott illetve zárt állapot a fehérje
kétféle
konformációját jelenti. A membrán nyugalmi állapotában a legtöbb
csatorna zárt
állapotban tartózkodik. (Kivételt képeznek pl. a fent említett
káliumcsatornák.) Ahhoz, hogy a csatorna kinyisson, valamilyen inger
szükséges.
Ez lehet egy kémiai jel, amikor valamilyen hírvivő molekula (ligandum)
kötődik
a fehérjéhez. Lehet mechanikai behatás, mint pl. a hallósejtekben.
Jelen dolgozat szempontjából
a feszültség-vezérelt (voltage gated)
ioncsatornák képezik a legfontosabb csoportot, mivel ide tartoznak az
itt
vizsgált kalcium- és nátriumcsatornák. Itt egy elektromos ingerület, az
ún.
akciós potenciál hatására nyit a csatorna. Ez az akciós potenciál nem
más, mint
a membránpotenciál hirtelen megváltozása.
Ezen a helyen szükséges
annak rövid ismertetése, hogy mi a jelentősége a kalcium és
nátrium-csatornáknak az idegrendszer működésében. Sok egyéb funkció
mellett
ezek az ioncsatornák itt játsszák a legfontosabb és legszemléletesebb
szerepet.
A nátriumcsatornáknak az ingerületnek az idegrost (axon)
mentén való továbbításában van nélkülözhetetlen szerepe.
Ehhez azt kell látni, hogy hogyan keletkezik az akciós potenciál. Ha a
sejt-membrán egy adott részére elektromos inger érkezik, azaz
megváltozik a
membránpotenciál, az ott levő nátriumcsatornák kinyitnak (valójában ez
is egy
valószínűségi kijelentés: nagyobb valószínűséggel tartózkodnak nyitott
állapotban). Mivel a nátriumionoknak a sejten kívül sokkal nagyobb a
koncentrációja
(ld. 1. táblázat), és erre a negatív nyugalmi membránpotenciál csak
„rásegít”,
egy nagy befelé mutató elektrokémiai gradiens érvényesül a
nátriumionokat
illetően, ami egy nagy nátriumion-fluxust eredményez. Ez az áram
viszont
megváltoztatja a nátriumionok koncentráció-arányát a membránnak a
nyitott
nátriumcsatornák melletti részén, és ezzel együtt a membrán-potenciált
is. Ez a
potenciálváltozás viszont nyitja az ott lévő nátriumcsatornákat. Ez a
ciklus az
alapja annak a folyamatnak, melynek során az elektromos ingerület a
membrán
felületén, azaz az idegrost mentén továbbterjed, mégpedig
gyengítetlenül. A
gyengítetlen tovaterjedéshez szükséges energiát a Na+-K+
pumpák által fenntartott Na+ és K+-koncentrációgradiens
biztosítja végeredményben kémiai energia (ATP) felhasználásával.
A kalciumcsatornák akkor
lépnek be a képbe, amikor az inger az idegvégződéshez ér. Ekkor az
elektromos
inger hatására a feszültségvezérelt kalciumcsatornák kinyitnak az
idegvégződésnél, avagy szinapszisnál, az idegvégződésbe áramló
kalciumionok az
ún. szinaptikus vezikulákban tárolt hírvivő molekulák, a
neurotranszmitterek
felszabadulását okozzák. Ily módon az elektromos ingerület kémiai
ingerületté
alakul át. A kémiai ingerület a neurotranszmitter-vezérelt ioncsatornák
nyitásával
alakul vissza elektromos ingerületté.
Az ioncsatornák szerkezete
A membránfehérjék pontos
szerkezetéről a tudásunk korlátozott. Egy fehérjemolekula szerkezetét
az őt
felépítő aminosavak sorrendje határozza meg. Ezt az aminosavszekvenciát
viszonylag nagy (sok aminosavból álló) fehérjék esetében is meg tudták
határozni, annak visszafejtése azonban, hogy a polipeptid lánc miféle
háromdimenziós szerkezetbe fog feltekeredni, csak viszonylag kicsi
fehérjék
esetében lehetséges. A membránfehérjék azonban többnyire igen nagy
molekulák.
A fehérjék szerkezetének
meghatározására használt legfőbb közvetlen módszer a röntgendiffrakció.
Ehhez
azonban, és ebben rejlik a fő nehézség, először kristályosítani kell az
adott
fehérje-molekulát. Ez nem könnyű feladat. A membrán-fehérjék esetében
kiváltképp nem az, mivel ezek a fehérjék egy speciális környezetben
helyezkednek el, középső részüket a lipid kettősréteg hidrofób része
veszi
körül, míg a két végük vizes közegben helyezkedik el. Tisztán vizes
oldatban a
fehérje más konformációba tekeredhet fel. Erről tanúskodik az, hogy míg
összesen több mint ezer fehérje szerkeze-tét sikerült megmérni, az
ismert
konformációjú membránfehérjék száma csupán néhány tucat.
Direkt és indirekt módszerek
segítségével azonban viszonylag átfogó képpel rendelkezünk az
ioncsatornák
szerkezetéről. Ezek a fehérjék ún. a-hélix kötegek formájában
járják keresztül a membránt, kialakítva így egy hidrofil pórust, ami az
ionok
transzportját lehetővé teszi. A KcsA bakteriális feszültségvezérelt
káliumcsatorna azon kevés ioncsatornák közé tartozik, amelyek
szerkezetét
röntgendiffrakciós mérésekből ismerjük (Roderick MacKinnon nem
véletlenül
kapott kémiai Nobel díjat4).
A csatorna átfogó szerkezete az 1. Ábrán látható. Úgy tartják, hogy a
lényeget
tekintve a kalciumcsatornák és nátriumcsatornák szerkezete ehhez nagyon
hasonló. Az egyik fő különbség, hogy míg a K csatornánál a négy ![]() -hélix
négy különálló fehérjéhez tartozik, addig a Na és Ca
csatornáknál azok egy fehérje alegységei. A másik fő különbség egy a
póruson
belüli szűk térrész, a szelektivitást meghatározó szelektív szűrő
szerkezetében
rejlik.
-hélix
négy különálló fehérjéhez tartozik, addig a Na és Ca
csatornáknál azok egy fehérje alegységei. A másik fő különbség egy a
póruson
belüli szűk térrész, a szelektivitást meghatározó szelektív szűrő
szerkezetében
rejlik.
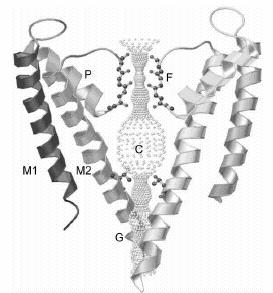
1.
ábra
A KcsA bakteriális káliumcsatorna vázlatos szerkezete. A
szűrő (F) a
sejten kívüli oldalon helyezkedik el és a P-spirálhoz tartozó
polipeptid láncok
határolják. A kapu (G) a sejten belüli oldalon helyezkedik el, középen
egy
hidrofil üreg (C) található3.
A KcsA csatorna esetében a
szűrőt a polipeptid vázhoz tartozó oxigénatomok határolják, és az
oldalláncok
kifele állnak. Ezzel szemben a nátrium- és kalciumcsatornák esetében az
aminosav oldal-láncok befele állnak, és az ioncsatorna szelektivitását
éppen az
határozza meg, hogy a szelektív szűrőt miféle aminosav oldalláncok
határolják.
A kalciumcsatornák esetében ezek az oldalláncok glutaminsavak (jelük:
E),
mégpedig négy darab (EEEE-locus). Ezek végén karboxilcsoportok
helyezkednek el,
általában deprotonált formában. A szelektív szűrőben így –4e töltés van
jelen,
ami a csatornát kationszelektívvé teszi. A szelektív szűrő kis
térfo-gata teszi
a csatornát kalciumszelektívvé, mivel a kalciumionok kétszer akkora
töltést szolgáltatnak
a töltött karboxilcsoportok semlegesítésére, mint a nátriumionok,
miközben
nagyjából ugyanakkora térfogatot foglalnak el. Ez a mechanizmus
egyszerű
fiziko-kémiai elvekkel magyarázza a csatorna kalci-umszelektivitását5. Jelen dolgozat célja,
hogy az ioncsatorna egy egyszerű, de jól definiált modelljére
végrehajtott
Monte Carlo szimulációk segítségével igazolja, hogy a fent leírt
mechanizmus
(melyet, magyarra meglehetősen nehezen lefordíthatóan, ‘charge-space
competition’ mechanizmusának neveztünk el) képes az
ionszelektivitás magyarázatára.
Ami a nátriumcsatornákat
illeti, a kísérletek alapján egy pozitívan töltött oldallánc, mint
például a
lizin (K) jelenléte szükséges ahhoz, hogy a csatorna monovalens
kationra legyen
szelektív. Jelenleg a DEKA (aszparaginsav: -1e, glutaminsav: -1e,
lizin: +1e,
alanin: semleges) sorrendet tartják legvalószínűbbnek2.
Itt a szelektív szűrő töltése összesen –1e, ami a
kalciumionok abszorpciója ellen hat, mivel egy kétszeres pozitív
töltésű ion
felvételével sérül az elektronegativitás. Génmutációs kísérletek azt
mutatták,
hogy a DEKA sorrendet EEEE sorrenddé változtatva, az ionszelektivitás
erőteljesen a kalciumion felé tolódott el, a nátriumcsatorna
kalciumcsatornává
változott. Ez arra utal, hogy az ionszelektivitást valóban a szelektív
szűrő
környezete szabályozza.
Modell
A statisztikus mechanikai
számítások, és ezen belül a Monte Carlo szimulációk mindig csak egy
valamilyen
jól definiált modellre végezhetők el. Minél egyszerűbbek ezek a
modellek, annál
könnyebben vizsgálhatók, annál kisebb a számítógépes szimulációk
időigénye. Bár
a mai számítógépek és az egyes membránfehérjékre eddig rendelkezésre
álló
szerkezeti ismeretek lehetővé teszik nagyon részletes, atomi szintű
modellek
felállítását és az ezeken alapuló százezres részecskeszámú, hónapokig
futó
szimulációk végrehajtását is, egyszerű modellek használata sokszor
célravezetőbb, több okból is. Egyrészt, lehetővé teszi több szimuláció
végrehajtását egy szélesebb koncentrációtartományban, és az
ionszelektivitás
vizsgálatához éppen ez szükséges. Másrészt egyszerű modellek
segítségével a
rendszer egy-egy jellemző tulajdonságát ragadhatjuk meg.
Jelen esetben, ahogy azt az
előző fejezetben már kifejtettük, egy olyan mechanizmust tesz-telünk,
amely
kizárólag az ionok töltésén és méretén keresztül határozza meg a
szelektivitást. (Természetesen a valóság sosem ilyen egyszerű, de a
jelenség
teljes megértése felé nagy lépést teszünk, ha megmutatjuk, milyen
mértékig
felelős azért két olyan alapvető tulajdonság, mint pl. az ionok töltése
és
mérete.) Ezért az ionokat töltött merev-gömbökkel modellezzük (az
ionátmérők a 2.
táblázatban találhatók). Az oldószer korpuszkuláris természetének
elhanyagolása
már nagyobb közelítés, de jelen esetben, mint látni fogjuk,
célravezető. Ezért
az elektrolitot az ún. primitív modellel reprezentáljuk, ahol az
oldószer
hatását egy dielektromos háttér formájában vesszük figyelembe. További
közelítés, hogy az ioncsatornában és az oldatban ugyanakkora
dielektromos
állandót használunk, a vízre jellemző e=78.5 értéket. Ez a
kontinuum modell elhanyagolja, hogy a szelektív szűrőben nyilvánvalóan
mások a
polarizációs hatások, mint tömbfázisban: az ionok feltehetően a
hidrátburkot
részben ledobva lépnek be a csatornába. Éppen ennek az
energiaveszteségnek a
pótlásához szükségesek a szűrőben lévő töltött vagy poláros
oldalláncok. A
fenti jelenségek vizsgálatára molekuláris szintű szimulációk
folyamatban
vannak, és a jövőben a kontinuum modell keretein belül is vizsgálni
szeretnénk
őket egy membránbeli, a tömbfázisétól különböző, attól alacsonyabb
lokális
dielektromos állandó alkalmazásával10. A dielektromos
határfelületeken
ébredő polarizációs töltések meghatározására kifejlesztettünk egy
numerikus
módszert, ami a felületi töltések számítását a felület diszkretizálása
után egy
mátrixegyenlet megoldására vezeti vissza11.
A szelektív szűrőt egy Rf
sugarú merev falú
hengerrel modellezzük, a membránt pedig két, egymástól Hf
távolságban lévő merev fallal, ahogy az az 2. ábrán
látható8,9. A membrán két
oldalán két tömbfázis helyezkedik el. Ezek eredetileg a citoplazmának
és a
sejten kívüli térrésznek felelnek meg, de hangsúlyozzuk, hogy
egyensúlyi
szimulációkat végzünk. Nem folyik áram, nincs sem koncentráció-, sem
potenciálgradiens. Ezért a két tömbfázis egymással ekvivalens, a
szimulációs
cella a membrán központi síkjára nézve szimmetrikus. A szimulációs
cella nagysága
z irányban H, periodikus határfeltételt
alkalmazunk, míg sugárirányban a cellát egy R
sugarú merev henger zárja le. Mind H-nak
és R-nek elég nagynak kell lenni,
hogy a szimuláció során a merev falaktól elegendően távol homogén
tömbfázist
kapjunk (a cella dimenzióit a 2. táblázat tartalmazza).
2. táblázat
Az ionok átmérője és a szimulációs cella dimenziói.
|
Ionátmérők Å-ben |
|
|
Na+ |
1.9 |
|
Ca++ |
1.98 |
|
Cl- |
3.62 |
|
O-1/2 |
2.8 |
|
NH4+ |
3 |
|
A szimulációs
cella dimenziói (Å) |
|
|
Rf |
5 |
|
R |
62.5 |
|
Hf |
10 |
|
H |
180-400 |
A szelektív szűrő lényegi
részét képező aminosav oldalláncokat mozgékonynak feltételezzük.
Például a
glutaminsavban a karboxilcsoport egy szénlánc végén lóg, mint egy
horgonyon. Ez
a szénlánc flexibilis, így a végén levő iont joggal feltételezhetjük
mobilisnak. (Arról nem is beszélve, hogy az oldalláncok pontos
elhelyezkedését
a szelektív szűrő körül nem ismerjük, erre vonatkozólag csak
feltételezések
vannak.) Ezért a karboxilcsoportban lévő oxigéneket két, egyenként
–1/2e
töltésű (D és E oldalláncok) merevgömbbel, a lizinben (K) lévő +1e
töltésű
aminocsoportot egy ammóniumionnal modellezzük (az ionátmérők
megtalálhatóak a
2. táblázatban). Az alanin (A) oldalláncát külön nem vesszük
figyelembe. Ezek
az ionok tehát szabadon mozoghatnak a szelektív szűrőn belül, de abból
nem
léphetnek ki.
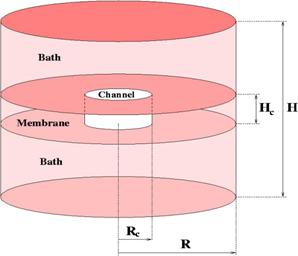
2.
ábra
A szimulációs cella.
Ahogy már említettük, a
szelektivitás valószínűségi fogalom, arra utal, hogy melyik iont milyen
valószínűséggel engedi át a csatorna. Ezekben a szimulációkban a
szelektivitást
egy egyensúlyi abszorpcióval jellemezzük. A kérdés az, hogy melyik ion
milyen
valószínűséggel tartózkodik a szelektív szűrőben, miközben a
tömbfázisban változtatjuk
az ionok koncentrációját. A vizsgálat menete a következő: végrehajtunk
egy
szimulációt tiszta 0.1 M-os NaCl-ra, majd fokozatosan CaCl2-ot
adagolunk
a rendszerhez miközben a Na+ ionok koncentrációját a
tömbfázisban
0.1 M-os állandó értéken tartjuk. Mivel NVT
(kanonikus) sokaságú szimulációt használunk, a tömbfázisbeli
koncentráció
természetesen a szimulációknak végeredménye. Ezért minden esetben egy
rövid
előzetes szimuláció futtatása szükséges, amelynek alapján a cella
hosszát (H) megváltoztatva nagyjából (1%-os hibán
belül) állandó nátriumkoncentrációt kapunk.
A Monte Carlo szimulációk
részletes magyarázatára itt részletesen nem térünk ki, lényegében egy
Boltzmann
eloszlás szerint súlyozva mintát veszünk a konfigurációs térből. A
szimuláció bemeneti
adatai a modellre jellemző mikroszkopikus paraméterek (ionátmérők,
töltések), a
jelen esetben merev falakkal modellezett külső kényszerek, azaz a cella
geometriája, valamint a termodinamikai állapot rögzítéséhez szükséges
állapotjelzők (részecskék száma, térfogat és hőmérséklet, T=298K).
A szimuláció eredménye a különböző ionok sűrűségprofiljai z
függvényében (a rendszer
henger-szimmetrikus). Ezekből a sűrűségprofilokból integrálás útján
számíthatók
a tömbfázisbeli koncentrációk, valamint az, hogy melyik típusú ionból
átlagosan
hány tartózkodik a szűrőben.
Eredmények
A kalciumcsatornára kapott szelektivitási görbék a 3. ábrán láthatók8. A szelektív szűrőben 8 oxigénion van. A szelektív szűrőben abszorbeált Na+ és Ca++ ionok átlagos számát ábrázoltuk a tömbfázisbeli kalcium- és nátriumion koncentrációk logaritmusának függvényében. Látható, hogy a csatorna erősen kalciumszelektív. Amikor az oldatban még százszor kevesebb kalciumion van, mint nátriumion, a csatorna már ekkor több kalciumiont abszorbeál, mint nátriumiont. A valóságban a kalciumcsatornák még ennél is szelektívebbek. Ez a modell további finomításának szükségességét jelzi.
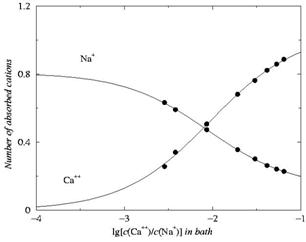
3.
ábra
A
kalciumcsatorna (EEEE-locus) szelektivitási görbéi.
A kalciumcsatornák esetében,
modellünk szerint, a kalciumszelektivitást az okozza, hogy a szelektív
szűrőben
nagy az ionsűrűség, és a jelen lévő negatív töltéseket a kalciumionok,
kétszeres töltésük révén, hatékonyabban tudják semlegesíteni. Áttérve a
szelektív szűrő körüli DEKA aminosav elrendezésre, reményeink szerint
egy
nátriumra szelektív csatornához jutunk. Ekkor 4 oxigén, és 1
ammóniumion
helyezkedik el a szelektív szűrőben. A szelektivitási görbék a 4. ábrán
láthatók9.
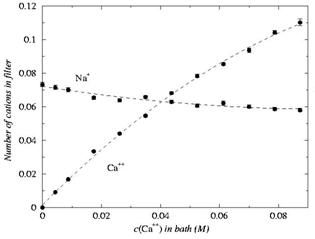
4.
ábra
A
nátriumcsatorna (DEKA-locus) szelektivitási görbéi.
Itt az x-tengelyen a
kalciumionok tömbfázisbeli koncentrációját ábrázoltuk. Látható, hogy ha
a
kalciumkoncentráció elég magas (0,04M), ez a csatorna is
kalciumszelektívvé
válik, de ez a koncentráció jóval a fiziológiai kalciumkoncentráció
(1-2 mM,
lásd 1. táblázat) felett van. Azaz, élettanilag releváns körülmények
között a csatorna
valóban nátriumcsatornaként viselkedik.
Szimulációink megmutatták,
hogy a kalcium- és nátriumcsatornára rendelkezésre álló strukturális
információk alapján egy leegyszerűsített modell állítható fel. Erre a
modellre
elemi statisztikus mechanikai módszerekkel kapott szelektivitási görbék
kvalitatív módon megfelelően reprodukálják azt a viselkedést, amit az
illető
csatornáktól elvárunk. A modell továbbfejlesztése révén, elsősorban a
polarizációs
hatások részletesebb leírásával, a jövőben a kísérleti adatokkal még
inkább
egyező eredményeket kaphatunk. Nem egyensúlyi módszerek (pl.
molekuladinamika)
segítségével a csatornák vezetési mechanizmusa is tanulmányozható lesz.
Köszönetnyilvánítás: a közleményben található eredmények egy nemzetközi együttműködés keretein belül születtek. Ezúton mondok köszönetet Douglas Hendersonnak és David Busathnak (Brigham Young University, Provo, USA), Wolfgang Nonnernak (Univer-sity of Miami School of Medicine, Miami, USA), Bob Eisenbergnek és Dirk Gillespienek (Rush Medical College, Chicago, USA).
Ajánlott
irodalom:
1. Alberts, Bray, Johnson, Lewis, Raff, Roberts, Walter: Essential Cell Biology, Garland Publishing, Inc. New York & London, 1998.
2. Hille, B.: Ionic Channels of Excitable Membranes, Sinauer Associates, Inc.: Sunderland, MA, 2001.
3. Tieleman, D. P., Biggin, P. C., Smith, G. R., Sansom, M. S. P.: Simulation Approaches to Ion Channel Structure-Function Relationships, 2001, Quaterly Reviews of Biophysics, 34, 473.
4. Doyle, D. A., Cabral, J. M., Pfuetzner, R. A., Kuo, A., Gulbis, J. M., Cohen, S. L:, Chait, B. T., MacKinnon, R.: The Structure of the Potassium Channel: Molecular Basis of K+ Conduction and Selectivity, 1998, Science, 280, 69.
5.
Nonner,
W., Catacuzzeno, L., Eisenberg, B.: Binding
and Selectivity in L-Type Calcium Channels: A Mean Spherical
Approximation,
2000, Biophysical Journal, 79, 1976.
Publikációk a
témakörben:
6. Boda, D., Busath, D. D., Henderson, D., Sokolowski, S.: Monte Carlo Simulation of the Mechanism for Channel Selectivity: The Competition Between Volume Exclusion and Charge Neutrality, 2000, J. Phys. Chem. B 104, 8903.
7. Boda, D., Henderson, D., Busath, D. D.: Monte Carlo Study of the Effect of Ion and Channel Size on the Selectivity of a Model Calcium Channel, 2001, J. Phys. Chem. B 105, 11574.
8. Boda, D., Henderson, D., Busath, D. D.: Monte Carlo Study of the Selectivity of Calcium Channels: Improved Geometrical Model, 2002, Molecular Physics, 100, 2361.
9.
Boda,
D., Busath, D. D., Eisenberg, B., Henderson, D., Nonner, W.: Monte Carlo Simulations of Ion Selectivity
in a Biological Na Channel: Charge Space Competition, 2002, Phys. Chem. Chem. Phys., 4, 5154.
10.
Boda,
D., Varga, T., Henderson, D., Busath, D. D., Nonner, W.,
Gillespie, D.,
Eisenberg, B.: Monte Carlo simulation study of a system with a
dielectric
boundary: Application to calcium channel selectivity, 2004, Mol.
Sim.,
30, 89.
11.
Boda,
D., Gillespie, D., Nonner, W., Henderson, D., Eisenberg, B.: Computing
induced charges in inhomogeneous dielectric media: Application in a
Monte Carlo
simulation of complex ionic systems, 2004, Phys. Rev. E, 69,
Art. No. 046702.