


Next: A Poisson-Boltzmann egyenlet megoldása
Up: Az elektrokémiai kettősréteg vizsgálata
Previous: A Poisson-egyenlet megoldása
A XX. század elején Gouy és Chapman egymástól függetlenül közölték a Poisson-egyenlet megoldását a Boltzmann-eloszlás feltételezésével. Ezért ez tulajdonképpen nem más, mint a Poisson-Boltzmann (PB) egyenlet. A Poisson-egyenlet "vezérli" az elektrosztatikát, a Boltzmann-eloszlás pedig a statisztikus mechanikát. Ugyanez a megközelítés használatos ionok szolvatációjánál tömbfázisban, ahol Debye-Hückel (DH) elméletnek hívják, illetve kolloidkémiában, ahol Derjaguin-Landau-Verwey-Overbeek (DLVO) egyenletnek nevezik. A biofizikában egyszerűen csak Poisson-Boltzmann egyenletnek nevezik. Az elmélet eleganciája és analitikus megoldása miatt még ma is széles körben használják a kísérleti eredmények analizálására.
Az elmélet feltételezi, hogy az ionok ponttöltések. Ez a feltételezés önmagában alacsony koncentrációkra korlátozza az elmélet érvényességi tartományát.
Írjuk fel a Poisson-egyenletet a különböző ionok sűrűségeloszlásainak (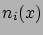 ) függvényében:
) függvényében:
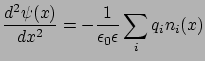 |
(13) |
Feltesszük, hogy ezekre a sűrűség eloszlásokra a Boltzmann eloszlás érvényes:
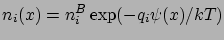 |
(14) |
ahol 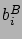 az illető komponens sűrűsége a tömbfázisban. Ez az egyenlet annak a valószínűségét adja meg, hogy az illető ion az
az illető komponens sűrűsége a tömbfázisban. Ez az egyenlet annak a valószínűségét adja meg, hogy az illető ion az 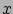 helyen tartózkodik. Ez a valószínűség annak az energiának az exponensével arányos, amit az illető ion az adott helyen felvesz
helyen tartózkodik. Ez a valószínűség annak az energiának az exponensével arányos, amit az illető ion az adott helyen felvesz 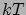 egységben mérve. Látható, hogy az egyenlet egy összefüggést állapít meg a potenciál és a sűrűség között. A másik egyenlet, ami egy ilyen összefüggést megállapít, az éppen a Poisson-egyenlet. A kettő együtt megoldható.
egységben mérve. Látható, hogy az egyenlet egy összefüggést állapít meg a potenciál és a sűrűség között. A másik egyenlet, ami egy ilyen összefüggést megállapít, az éppen a Poisson-egyenlet. A kettő együtt megoldható.
A fenti Boltzmann-eloszlás megkapható az elektrokémiai potenciálokra vonatkozó egyensúlyi feltételből.
Az 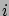 -edik szpecies elektrokémiai potenciálja:
-edik szpecies elektrokémiai potenciálja:
![$\displaystyle \mu_{i}=kT\ln \left[ \Lambda_{i}n_{i}(x)\right] + q_{i}\psi(x)$](img35.png) |
(15) |
A jobb oldalon az első tag az ideális gáz kémiai potenciálját adja (ne feledjük, hogy a részecskék pontszerűek), a második tag az elektrosztatikus energiát. A kettőből áll össze az elektrokémiai potenciál.
A rendszer az elektród közelében egyensúlyban van a rendszerrel távol az elektródtól, azaz a tömbfázissal.
A tömbfázisban a kémiai potenciál
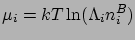 |
(16) |
A tömbfázisban 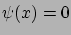 . A két (elektro)kémiai potenciál egyenlőségéből éppen a Boltzmann-eloszlás következik. Vegyük észre, hogy az ionok pontszerűnek való feltételezése kulcsfontosságú. Ha az ionok mérettel rendelkeznének, entropikus tagok jelennének meg. Ezeket a szimuláció magától értetődően szolgáltatja, és ha elmélettel akarnánk kiszámítani őket, egy az elektrosztatikus energiára vonatkozó egyszerű Boltzmann-eloszlásnál fejlettebb statisztikus mechanikai elméletre van szükségünk. Léteznek ilyen elméletek, pl. különböző integrálegyenletek, a főkömbi közelítés, vagy sűrűségfunkcionál-elméletek.
. A két (elektro)kémiai potenciál egyenlőségéből éppen a Boltzmann-eloszlás következik. Vegyük észre, hogy az ionok pontszerűnek való feltételezése kulcsfontosságú. Ha az ionok mérettel rendelkeznének, entropikus tagok jelennének meg. Ezeket a szimuláció magától értetődően szolgáltatja, és ha elmélettel akarnánk kiszámítani őket, egy az elektrosztatikus energiára vonatkozó egyszerű Boltzmann-eloszlásnál fejlettebb statisztikus mechanikai elméletre van szükségünk. Léteznek ilyen elméletek, pl. különböző integrálegyenletek, a főkömbi közelítés, vagy sűrűségfunkcionál-elméletek.
A Boltzmann-eloszlást (14. egyenlet) a Poisson-egyenletbe (13) helyettesítve kapjuk a Poisson-Boltzmann egyenletet:
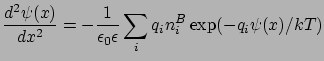 |
(17) |



Next: A Poisson-Boltzmann egyenlet megoldása
Up: Az elektrokémiai kettősréteg vizsgálata
Previous: A Poisson-egyenlet megoldása
Boda Dezso
2005-02-17
![]() ) függvényében:
) függvényében:
![]() -edik szpecies elektrokémiai potenciálja:
-edik szpecies elektrokémiai potenciálja: